Come gli enzimi umwelt und Geomatik costruiscono gli alberi di zucchero
I ricercatori hanno utilizzato la microscopia crioelettronica per chiarire per la prima volta la struttura e la funzione di un piccolo enzima presente nelle membrane cellulari. Questo enzima costruisce strutture complesse a partire da molecole di zucchero. I risultati potrebbero accelerare lo sviluppo di nuovi farmaci a base di proteine.
Molte proteine di membrana delle cellule degli organismi superiori sono dotate di complesse strutture di molecole di zucchero, i cosiddetti glicani. Questi alberi molecolari di zucchero non sono solo estremamente diversi, ma anche caratteristici del rispettivo organismo, di un tipo di cellula o del suo grado di differenziazione. Per esempio, i diversi glicani sono anche la chiave dei diversi gruppi sanguigni negli esseri umani.
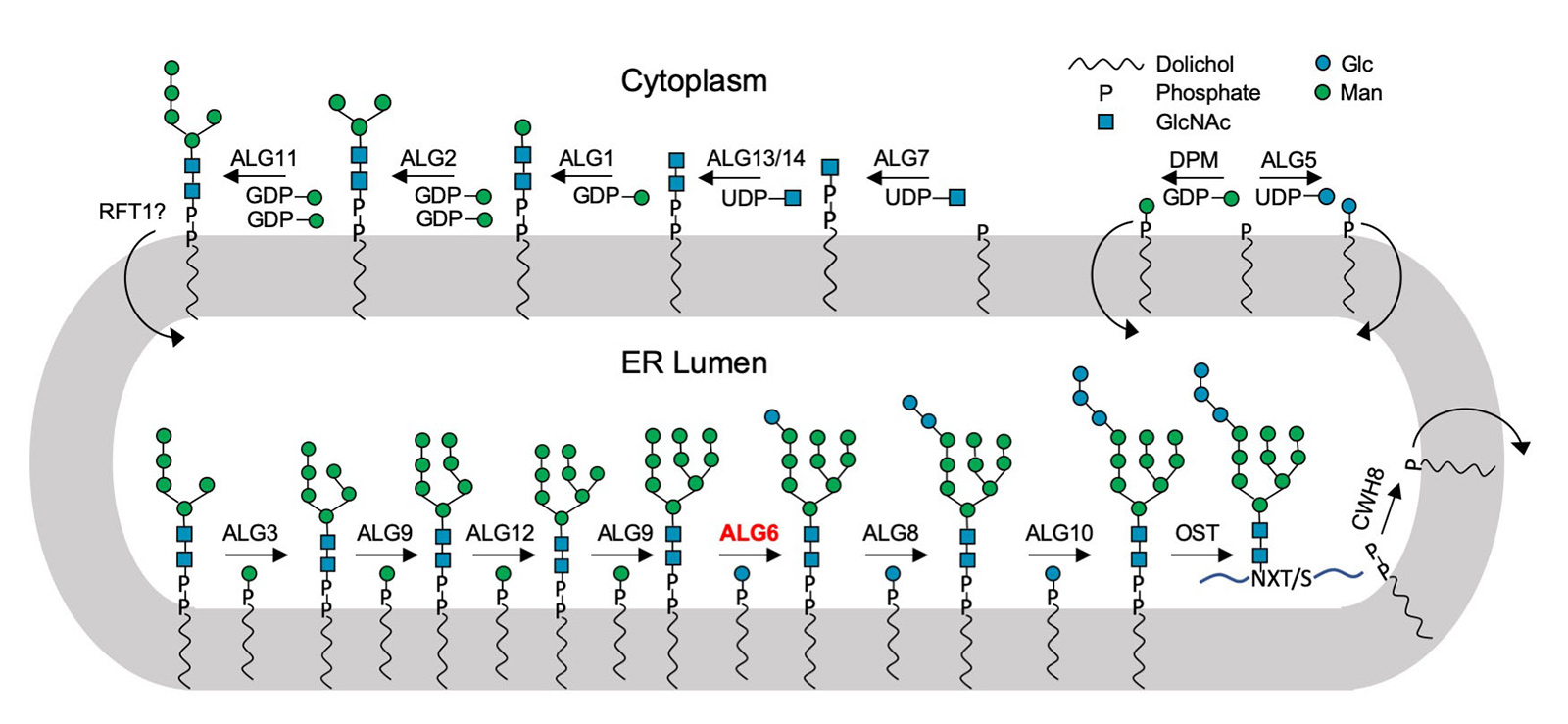
Una classe speciale di glicani è costituita da molecole di zucchero legate ai lipidi: gli oligosaccaridi legati ai lipidi. Questi consistono in una molecola di grasso ancorata alla membrana cellulare e in una parte di zucchero che si proietta all'interno degli organelli cellulari o all'esterno della cellula.
I ricercatori dell'ETH di Zurigo, dell'Università di Berna e dell'Università di Chicago hanno ora delucidato la struttura di uno degli enzimi responsabili della formazione di oligosaccaridi legati ai lipidi. Lo studio è stato pubblicato sull'ultimo numero della rivista scientifica Nature.
Architettura modulare delle proteine
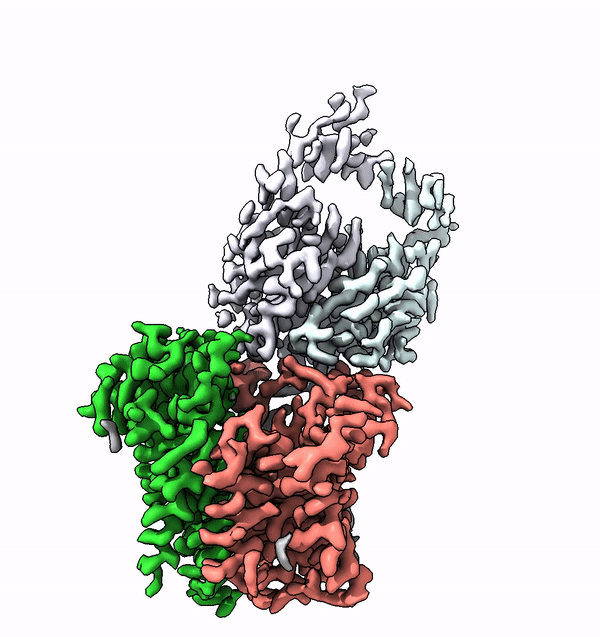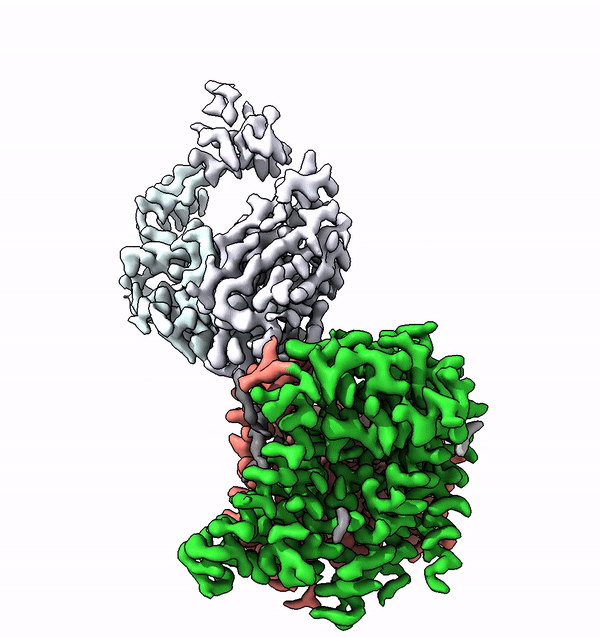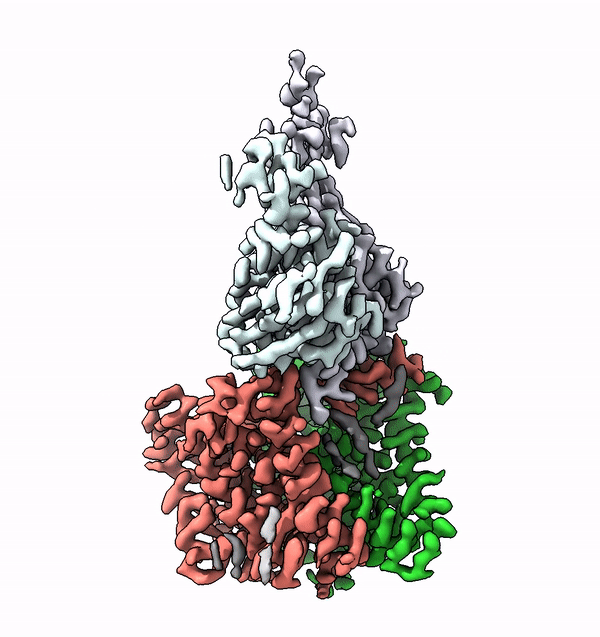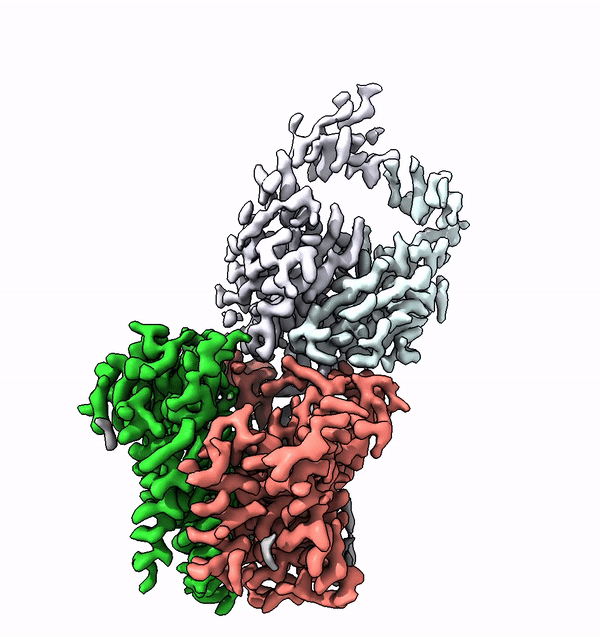
L'enzima trovato, chiamato ALG6, è un membro di un'intera superfamiglia di enzimi che i ricercatori chiamano glicosiltransferasi di categoria C. Si trovano nelle membrane cellulari e accoppiano molecole di zucchero più semplici ad altri zuccheri per costruire alberi di zucchero. Inoltre, collegano molecole di zucchero e persino interi alberi di zucchero con le proteine. Questa famiglia di enzimi svolge quindi diversi ruoli biologici chiave in tutti i tipi di organismi, da batteri e funghi a mammiferi altamente sviluppati.
Questa superfamiglia di enzimi è stata a lungo un mistero per i biologi, poiché le strutture dei singoli membri della famiglia hanno poco in comune. L'unico denominatore comune è che si tratta di proteine di membrana che trasferiscono zuccheri da una molecola all'altra e che gli zuccheri utilizzati per il trasferimento sono sempre legati a lipidi.
Utilizzando la struttura di ALG6, il gruppo guidato dal professor Kaspar Locher dell'ETH ha scoperto che i membri di questa famiglia di enzimi hanno una struttura modulare. Sembra che l'ALG6 e i suoi parenti siano costituiti da un modulo la cui struttura si è conservata nel corso dell'evoluzione e da un secondo modulo strutturalmente variabile.
"Sospettiamo che la struttura modulare abbia permesso agli enzimi di evolversi in diverse direzioni e quindi di accedere e convertire un'ampia gamma di substrati diversi", afferma Jo?l Bloch, dottorando del gruppo di Locher e primo autore dello studio.
I risultati di ricerca spiegano per la prima volta il meccanismo di questa famiglia di enzimi. "Questo ha implicazioni di vasta portata per la biologia cellulare e per la produzione di sostanze terapeutiche basate sulla biologia degli zuccheri", spiega il dottorando dell'ETH. In particolare, la produzione di anticorpi terapeutici personalizzati, a cui l'industria farmaceutica è molto interessata, potrebbe beneficiare delle nuove scoperte.
Record nella microscopia crio-elettronica
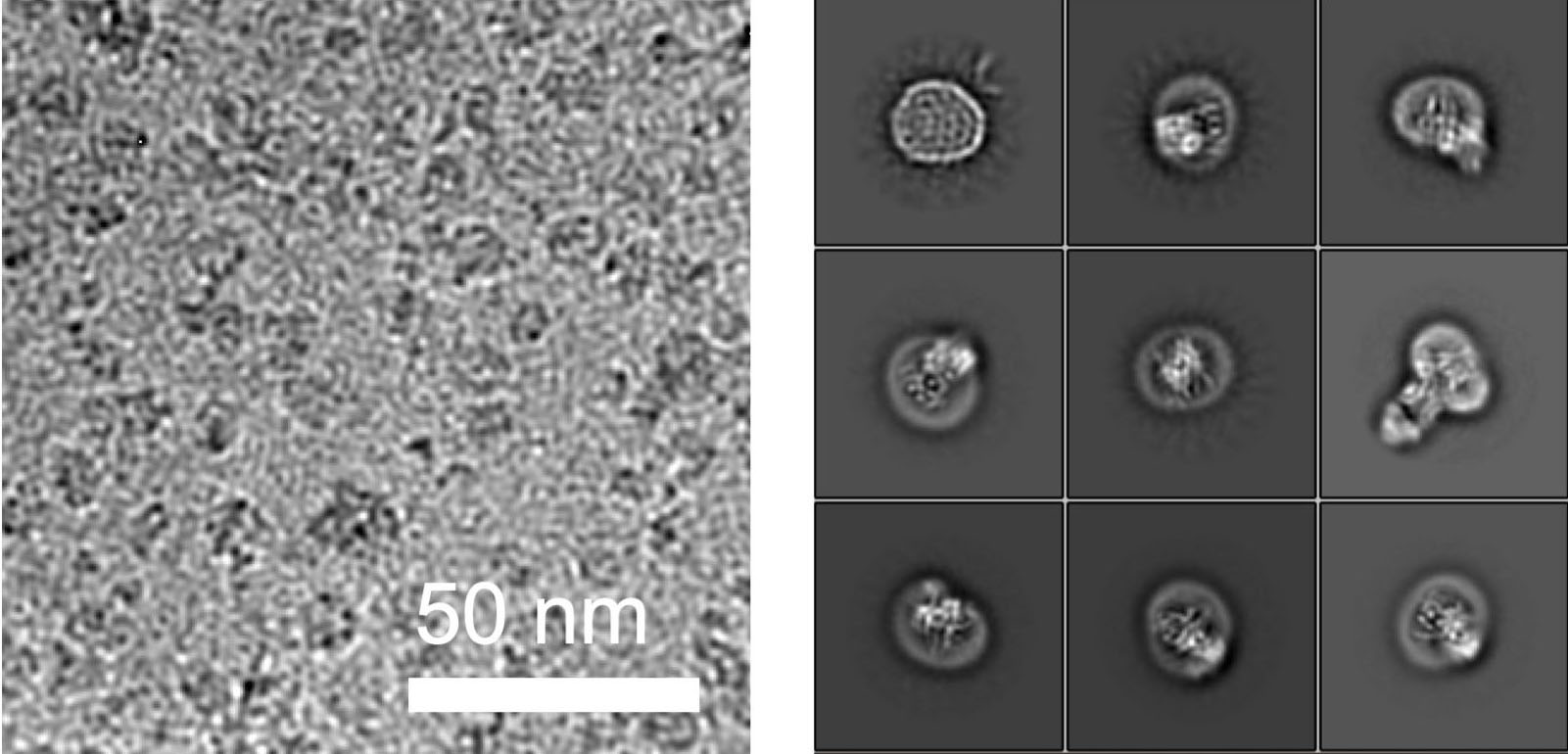
I ricercatori considerano inoltre i loro risultati come una svolta nell'elucidazione delle strutture molecolari delle proteine utilizzando la crio-microscopia elettronica (cryo-EM). Questa tecnologia innovativa, per la quale il premio Nobel per la chimica 2017 è stato assegnato, tra gli altri, al vodese Jacques Dubochet, è diventata il metodo più importante per delucidare la struttura di grandi complessi molecolari. Tuttavia, l'elucidazione strutturale ad alta risoluzione di piccole proteine, specialmente quelle incorporate nelle membrane, non è stata possibile. Il motivo: i dati di microscopia delle piccole particelle misurate rendono impossibile un calcolo strutturale preciso nell'elucidazione della struttura.
I ricercatori del Fare all'ETH sono riusciti a risolvere questo problema in collaborazione con un gruppo di ricerca dell'Università di Chicago. In collaborazione con i ricercatori del Politecnico, hanno prodotto un anticorpo sintetico che si lega all'ALG6. Questo anticorpo ha aumentato il peso dell'enzima ALG6 in modo tale da poterne delucidare la struttura ad alta risoluzione con la crio-EM.
"La risoluzione così ottenuta è attualmente il record mondiale per la risoluzione strutturale di un complesso legato alla membrana di queste dimensioni", afferma con orgoglio Kaspar Locher. Questo ulteriore sviluppo della crio-EM consentirà a molti altri scienziati di delucidare le strutture di piccole proteine di membrana. "Ciò consentirà alla scienza di compiere rapidi progressi nello studio delle proteine di membrana associate a diverse malattie", sottolinea l'ETH.
Un kit di costruzione chemio-enzimatico
Ma non è tutto: in collaborazione con i chimici dell'Università di Berna, i ricercatori dell'ETH hanno sviluppato metodi di sintesi con i quali sono riusciti a produrre in laboratorio oligosaccaridi altamente complessi legati ai lipidi. In precedenza, ciò non era possibile con le sintesi convenzionali della chimica degli organi.
Ciò ha fornito ai ricercatori nuove conoscenze sulla via metabolica essenziale per la biosintesi degli oligosaccaridi legati ai lipidi. Gli scienziati possono ora spiegare meglio come le cellule producono i glicani complessi. "Si tratta di una pietra miliare della glicobiologia che potrebbe essere importante per la produzione di composti zucchero-proteina in futuro", afferma Locher.
Riferimento alla letteratura
Bloch J et al. Struttura e meccanismo della glucosiltransferasi ALG6 basata su ER. Nature, pubblicato online il 26th Febbraio 2020. doi: pagina esterna10.1038/s41586-020-2044-z
Articoli correlati
L'enzima che incolla lo zucchero alle proteine (Notizie ETH 08.02.2018)