L'enzima che incolla lo zucchero alle proteine
I ricercatori dell'ETH sono riusciti a delucidare la struttura 3D dell'enzima che attacca le catene di zucchero alle proteine - una scoperta che hanno recentemente pubblicato sulla rivista scientifica "Science".
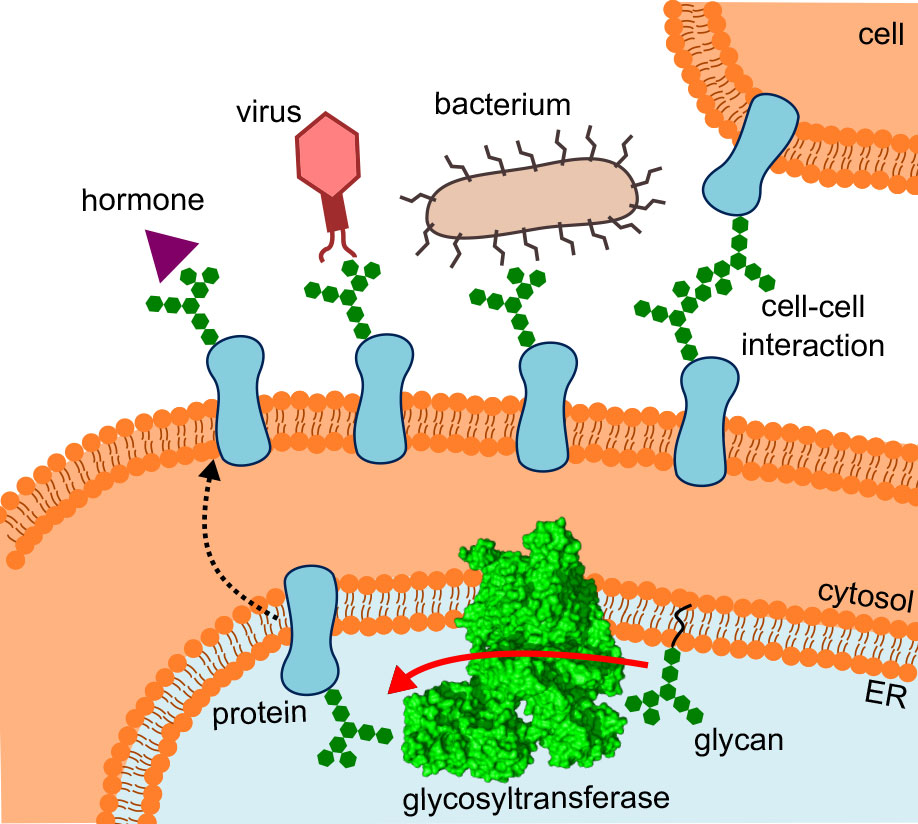
Quando le cellule ricevono segnali, interagiscono con altre cellule o riconoscono virus e batteri, non sono sempre coinvolte solo le proteine, ma anche le catene di zucchero che sono attaccate alla loro superficie. Queste strutture, che finora hanno ricevuto poca attenzione e hanno composizioni e ramificazioni molto diverse, apparentemente sponsorizzano le proteine a ripiegarsi correttamente e a svolgere i loro compiti specifici.
Diverse osservazioni dimostrano l'importanza delle appendici di zucchero: Le stesse proteine con catene di zucchero diverse hanno funzioni diverse. Le cellule malate e quelle sane sponsorizzano una diversa composizione di zuccheri sulla loro superficie. E i farmaci etichettati con questi zuccheri sono apparentemente meglio tollerati.
Come lo zucchero entra nelle proteine?
Attualmente è in corso un'intensa attività di ricerca sui cosiddetti glicani. Dopo la genomica e la proteomica, ora c'è anche la glicomica. Il campo di ricerca emergente della glicobiologia si occupa della biosintesi, della struttura e delle diverse funzioni delle appendici di zucchero. Una domanda centrale è come le diverse molecole di zucchero arrivino sulle proteine.
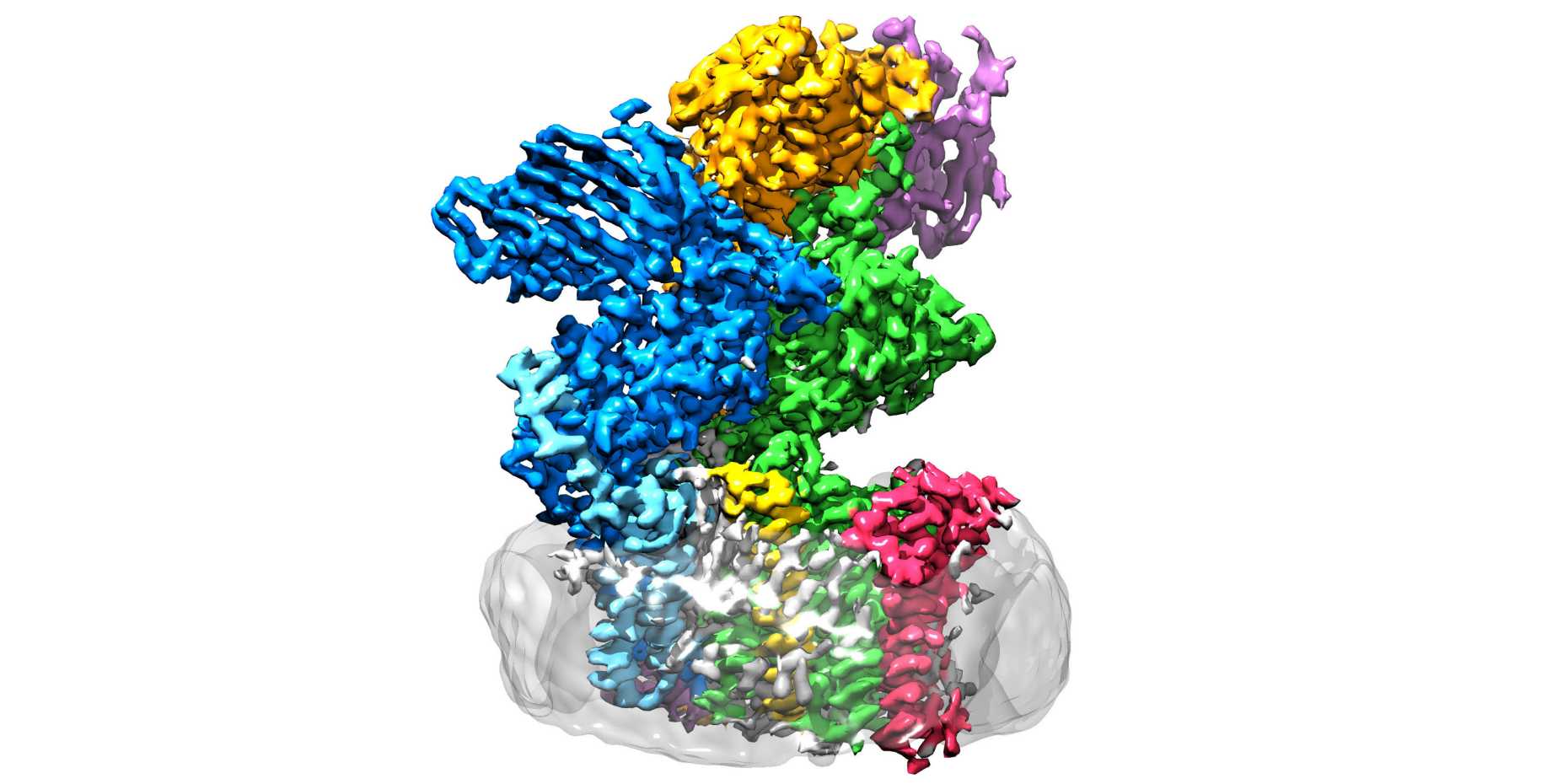
I ricercatori dell'ETH dei gruppi di Kaspar Locher, dell'Istituto di biologia molecolare e biofisica, e di Markus Aebi, dell'Istituto di microbiologia, hanno ora compiuto un passo decisivo nella ricerca in questo settore: hanno delucidato la struttura tridimensionale dell'oligosaccariltransferasi (OST) nel lievito. "Si tratta dell'enzima che collega le proteine e gli 'alberi di zucchero'", spiega Rebekka Wild, una delle tre autrici principali del lavoro "pagina esternaScienza", in cui i ricercatori dell'ETH presentano i loro risultati.
La microscopia crioelettronica lo rende possibile
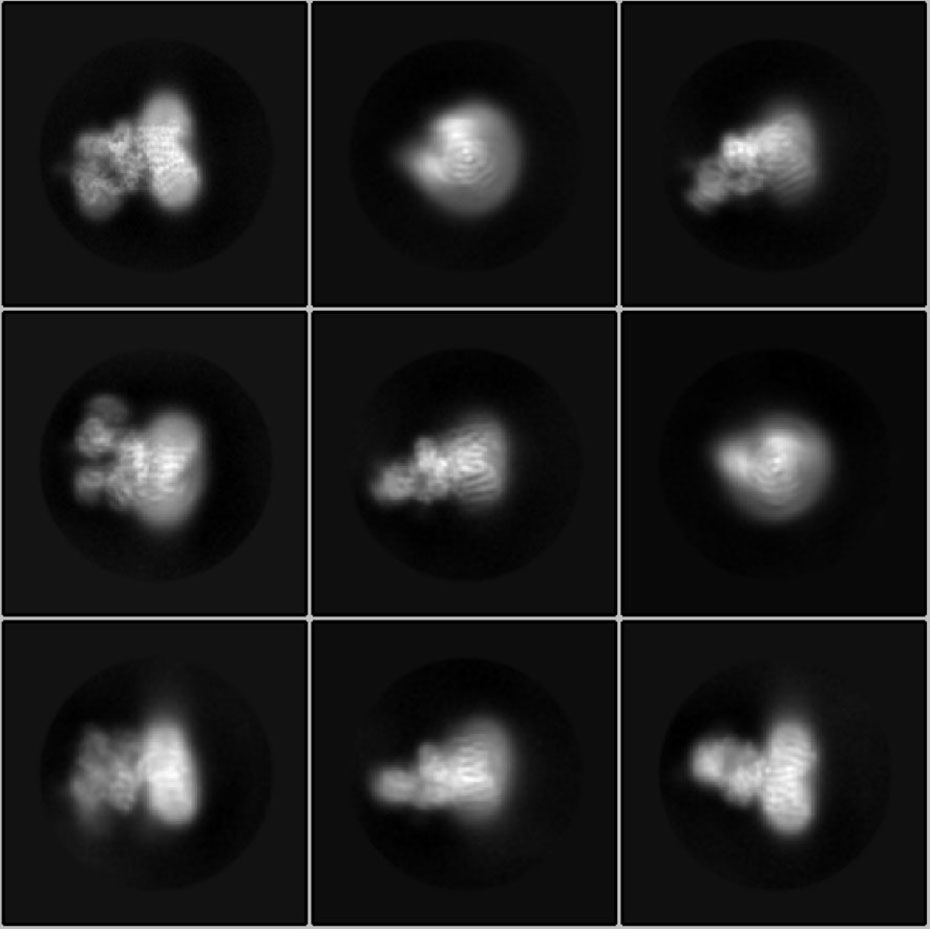
Chiarire la struttura dell'OST non è stato facile: per prima cosa Jilliane Eyring, la terza autrice della pubblicazione, ha modificato le cellule di lievito in modo tale da poter purificare l'enzima in modo mirato. Rebekka Wild ha poi dovuto estrarre l'enzima, che è incorporato in una membrana della cellula, da grandi quantità di queste cellule di lievito e poi purificarlo con grandi spese. "Nove litri di lievito hanno prodotto circa 0,2 milligrammi di enzima", spiega la ricercatrice. Le molecole di OST sono state poi congelate d'urto come particelle singole e separate e sono state analizzate con un microscopio crioelettronico ad alta risoluzione.
Ne sono risultate migliaia di immagini che mostrano il complesso enzimatico da tutte le angolazioni possibili. Julia Kowal, secondo autore principale della pubblicazione su Science, ha utilizzato queste immagini per calcolare la struttura tridimensionale dell'OST. Il computer l'ha calcolata per sei settimane. Il risultato: una cosiddetta mappa di microscopia elettronica, in cui l'enzima è rappresentato come una sorta di nuvola di elettroni.
Tempismo favorevole
"Abbiamo colto un momento fortunato", spiega Wild. Nel suo lavoro ha potuto beneficiare dell'attuale "rivoluzione della risoluzione" nella microscopia crioelettronica e utilizzare un dispositivo all'avanguardia con una risoluzione quasi atomica. Lo sviluppo di questa tecnologia è stato premiato con il Premio Nobel per la Chimica nel 2017.
Per interpretare i dati della microscopia elettronica, Wild ha dovuto inserire "a mano" la sequenza aminoacidica dell'OST nelle "nuvole" della mappa tridimensionale. In questo modo, la ricercatrice è riuscita a mappare la struttura tridimensionale dell'OST con tutti i suoi dettagli: una scoperta che ha suscitato grande entusiasmo tra i ricercatori dopo la pubblicazione online.
Il pezzo del puzzle che combacia
L'OST è un complesso proteico di membrana ed è costituito da otto subunità. Queste riconoscono lo zucchero o la proteina, ad esempio, o stabilizzano l'unità catalitica. Quest'ultima è la subunità dell'enzima in cui si trova il cosiddetto centro attivo, dove proteine e zuccheri vengono riuniti e fusi. "Ci aspettavamo che l'unità catalitica fosse situata al centro dell'enzima", spiega Wild. "Invece, sorprendentemente, si trova all'esterno dell'enzima. E la sua forma ricorda una bocca spalancata".
Ciò che inizialmente lasciava perplessi i ricercatori ha improvvisamente acquisito senso quando i ricercatori hanno individuato la struttura in cui l'OST viene effettivamente utilizzato: in vivo, l'enzima è incorporato nella membrana del reticolo endoplasmatico (ER). Questo è il luogo della cellula in cui le proteine vengono prodotte, ripiegate, controllate e modificate.
Il vicino diretto dell'OST - questo si sapeva già - è una proteina tunnel. Questa proteina canalizzatrice trasporta le proteine nascenti all'interno del reticolo endoplasmatico e lì direttamente nella bocca aperta dell'OST. ? qui che le giovani proteine ricevono i loro zuccheri.
Un buon modello per l'enzima umano
"L'OST del lievito è un buon modello per i processi nell'uomo", spiega Wild. I ricercatori hanno tratto questa conclusione dal fatto che il centro attivo, dove le proteine sono dotate di zuccheri, è molto simile nell'OST del lievito alla zona corrispondente nei batteri. "Il centro attivo non è praticamente cambiato nel corso dell'evoluzione", spiega il ricercatore, "il che significa che probabilmente funziona ancora in modo molto simile nei mammiferi e quindi anche nell'uomo".
Riferimento alla letteratura
Wild R, Kowal J, Eyring J, Ngwa EM, Aebi M, Locher KP. La struttura del complesso di oligosaccariltransferasi del lievito fornisce indicazioni sulla N-glicosilazione eucariotica. Science 04 Jan 2018: eaar5140. DOI: pagina esterna10.1126/science.aar5140