Comment les enzymes construisent des arbres à sucre
Les chercheurs ont pour la première fois élucidé la structure et la fonction d'une petite enzyme logée dans les membranes cellulaires à l'aide de la cryo-microscopie électronique. Celle-ci construit des structures complexes à partir de molécules de sucre. Ces découvertes pourraient accélérer le développement de nouveaux médicaments à base de protéines.
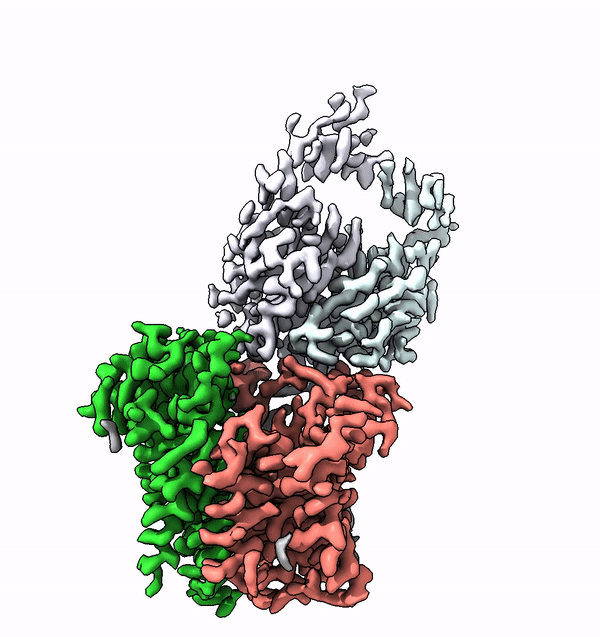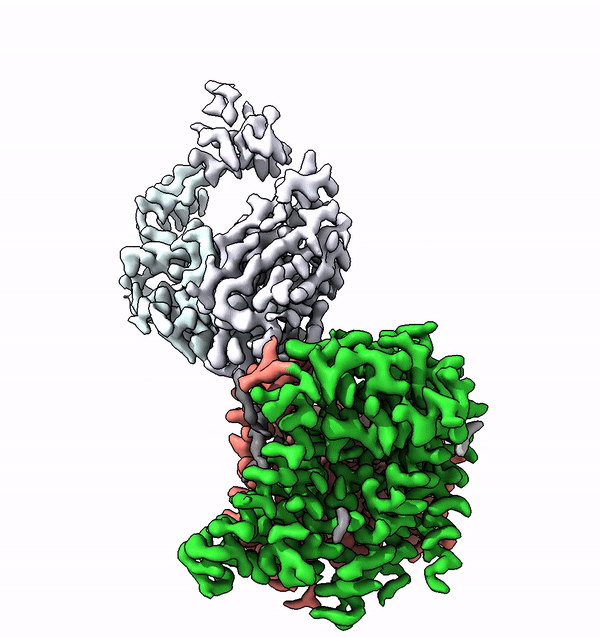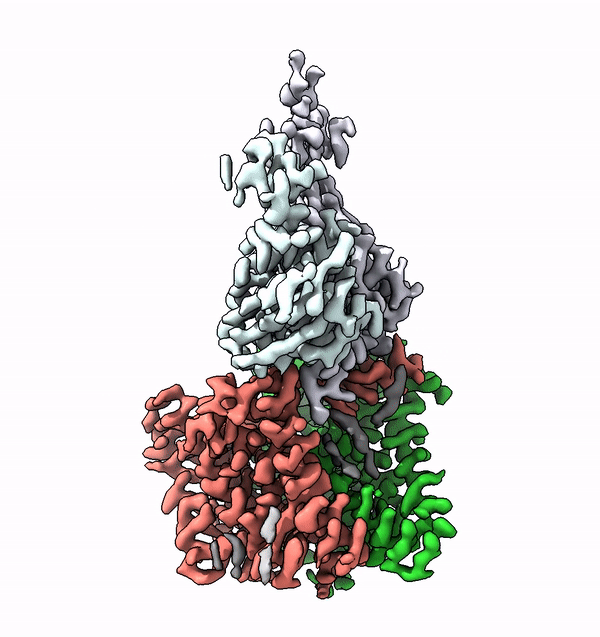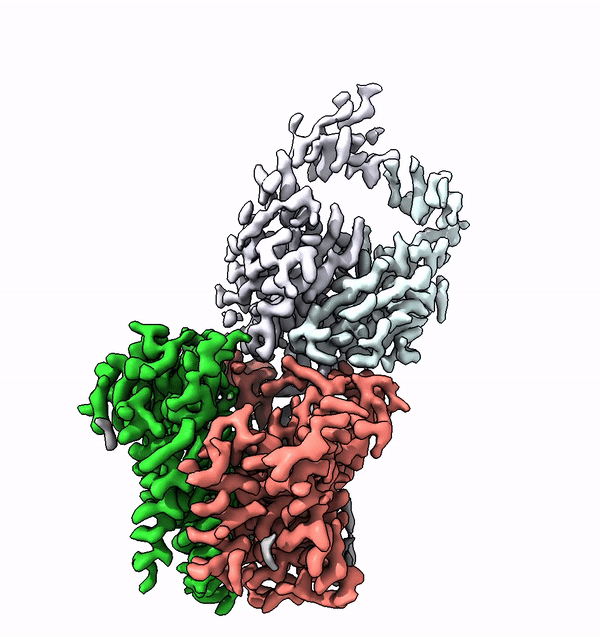
Dans les cellules des êtres vivants supérieurs, de nombreuses protéines membranaires sont équipées de structures complexes de molécules de sucre, appelées glycanes. Ces arbres moléculaires de sucre ne sont pas seulement extrêmement variés, ils sont également caractéristiques de l'organisme, du type de cellule ou du degré de différenciation. Les différents glycanes sont par exemple la clé des différents groupes sanguins chez l'homme.
Les molécules de sucre liées à des lipides constituent une classe particulière de glycanes : les oligosaccharides liés à des lipides. Ils sont constitués d'une molécule de graisse ancrée dans la membrane cellulaire et d'une partie sucre qui fait saillie soit à l'intérieur des organelles cellulaires, soit dans l'espace extérieur de la cellule.
Des chercheurs de l'ETH Zurich, de l'Université de Berne ainsi que de l'Université de Chicago viennent d'élucider la structure de l'une des enzymes responsables de la formation des oligosaccharides liés aux lipides. L'étude correspondante a été publiée dans le dernier numéro de la revue spécialisée Nature.
Architecture modulaire des protéines
L'enzyme trouvée, appelée ALG6, est membre de toute une super-famille d'enzymes que les chercheurs appellent glycosyltransférases de catégorie C. Elles se trouvent dans les membranes cellulaires et couplent des molécules de sucre plus simples à d'autres sucres pour former des arborescences de sucre. Elles relient en outre des molécules de sucre et même des arbres entiers de sucre à des protéines. Cette famille d'enzymes joue ainsi plusieurs r?les biologiques clés, et ce dans toutes sortes d'organismes, des bactéries aux mammifères évolués en passant par les champignons.
Pour les biologistes, cette superfamille d'enzymes a longtemps été une énigme, car les structures des différents membres de la famille n'ont guère de points communs. Le seul dénominateur commun était qu'il s'agit de protéines membranaires qui transfèrent des sucres d'une molécule à une autre et que les sucres utilisés pour le transfert sont toujours liés à des lipides.
En utilisant la structure de l'ALG6, le groupe dirigé par le professeur de l'ETH Kaspar Locher a maintenant découvert que les membres de cette famille d'enzymes ont une structure modulaire. Il semble que l'ALG6 et ses apparentés soient constitués d'un module dont la structure a été conservée au cours de l'histoire du développement, ainsi que d'un second module structurellement variable.
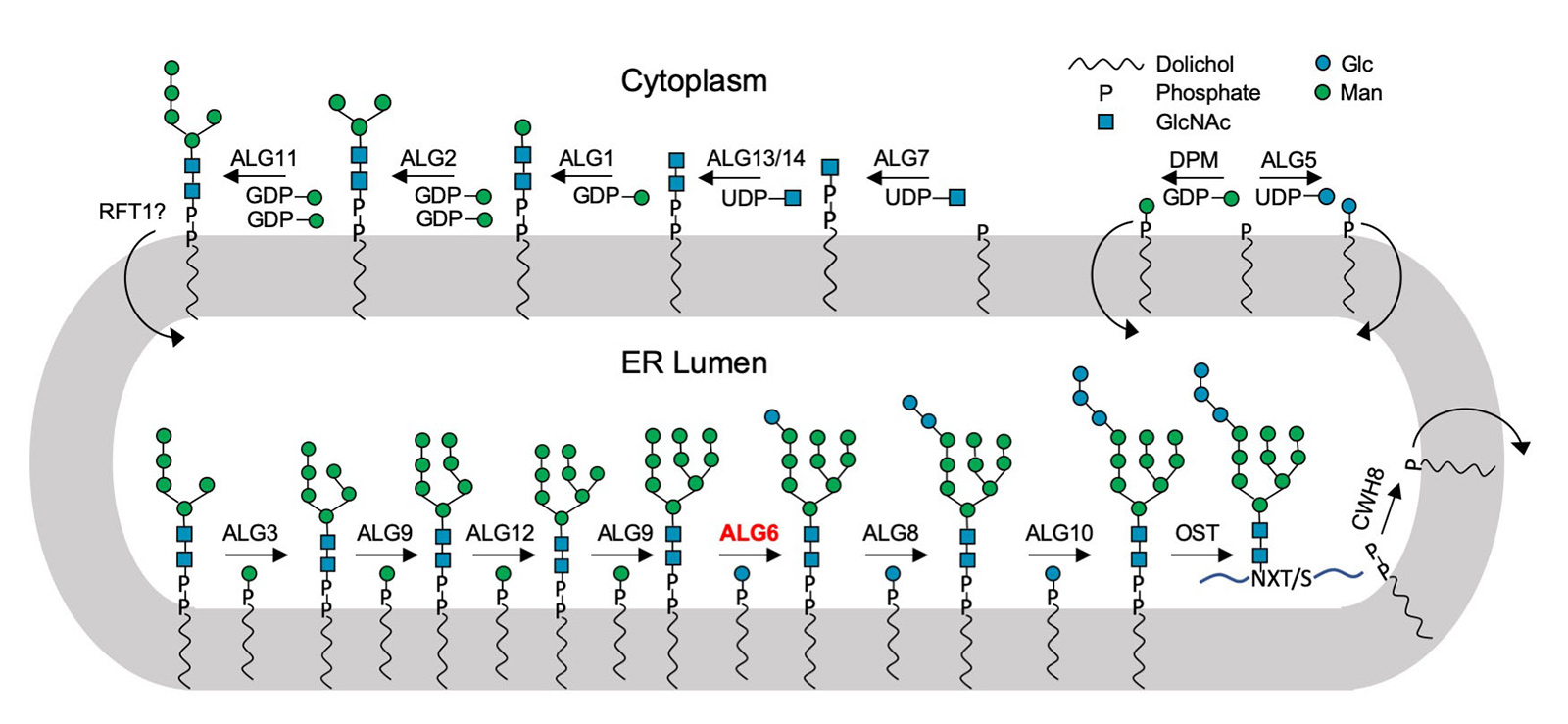
"Nous supposons que l'architecture modulaire a permis aux enzymes d'évoluer dans différentes directions et donc d'accéder à un large éventail de substrats différents et de les mettre en ?uvre", explique Jo?l Bloch, doctorant dans le groupe de Locher et premier auteur de l'étude.
Les résultats de la recherche expliquent pour la première fois le mécanisme de cette famille d'enzymes. "Cela a des conséquences importantes pour la biologie cellulaire ainsi que pour la fabrication de substances thérapeutiques basées sur la biologie des sucres", explique le doctorant de l'ETH. La fabrication d'anticorps thérapeutiques sur mesure, à laquelle s'intéresse fortement l'industrie pharmaceutique, pourrait notamment bénéficier de ces nouvelles découvertes.
Record en cryo-microscopie électronique
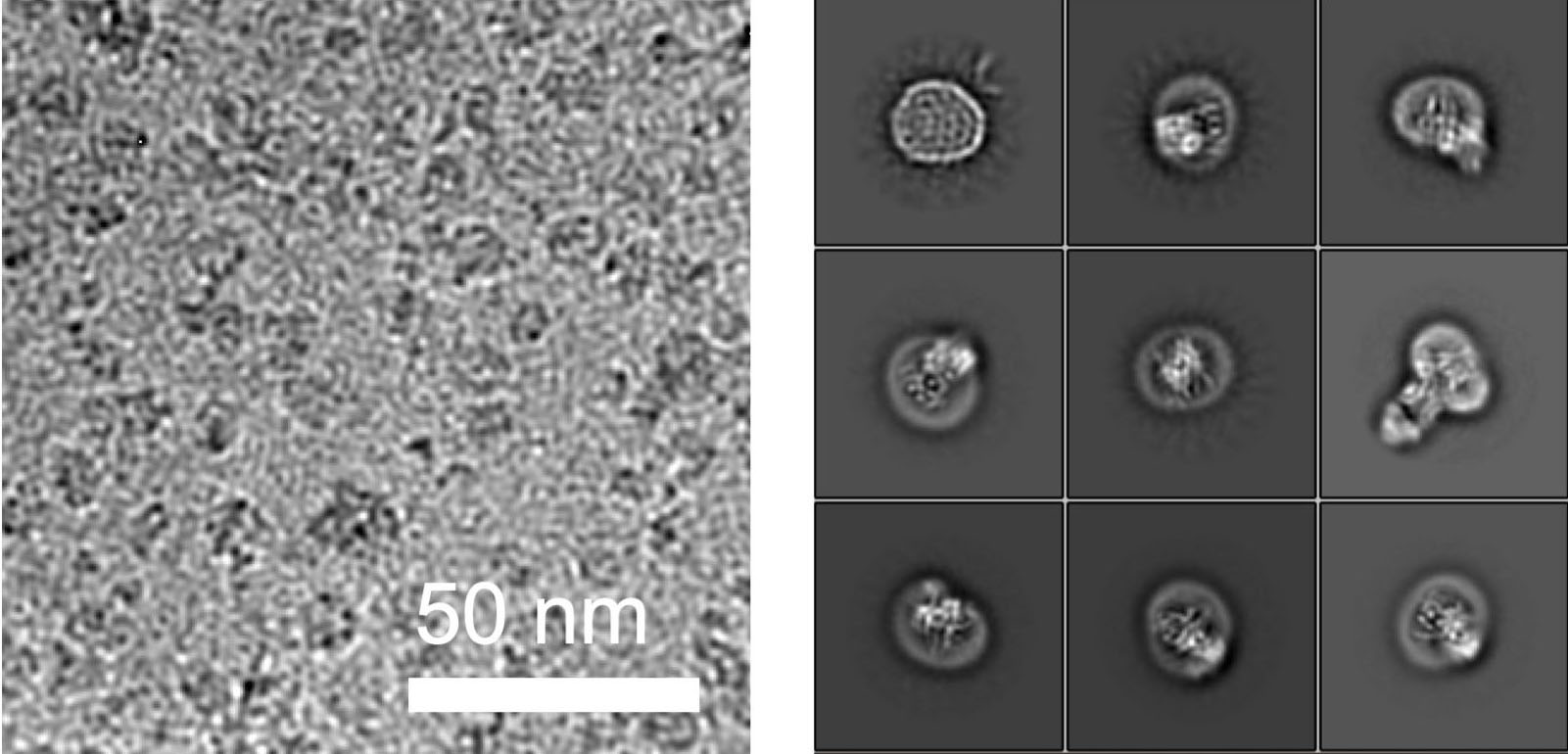
Les chercheurs considèrent en outre leurs résultats comme une percée dans l'élucidation des structures moléculaires des protéines par cryo-microscopie électronique (cryo-EM). Cette technologie révolutionnaire, pour laquelle le prix Nobel de chimie a été décerné en 2017, entre autres, au Vaudois Jacques Dubochet, est devenue la principale méthode d'élucidation de la structure de grands complexes moléculaires. En revanche, elle n'a pas permis d'élucider la structure à haute résolution des petites protéines, en particulier de celles qui sont intégrées dans des membranes. La raison : les données de microscopie des petites particules mesurées rendent impossibles des calculs structurels précis dans l'élucidation de la structure.
Les chercheurs de l'ETH ont maintenant pu résoudre ce problème en collaboration avec un groupe de recherche de l'Université de Chicago. En collaboration avec les chercheurs locaux, ils ont produit un anticorps synthétique qui se lie à l'ALG6. Cet anticorps a augmenté le poids de l'enzyme ALG6 de telle sorte que sa structure a pu être élucidée en haute résolution à l'aide de la cryo-EM.
"La résolution obtenue de cette manière est actuellement le record mondial de résolution structurelle d'un complexe de cette taille lié à une membrane", déclare Kaspar Locher non sans fierté. Selon lui, ce perfectionnement de la cryo-EM permettra à de nombreux autres scientifiques d'élucider les structures de petites protéines membranaires. "Cela permettra à la science de progresser rapidement dans l'étude des protéines membranaires liées à un grand nombre de maladies", souligne le professeur de l'ETH.
Un jeu de construction chimio-enzymatique
Mais ce n'est pas tout : en collaboration avec des chimistes de l'Université de Berne, les chercheurs de l'ETH ont développé des méthodes de synthèse qui leur ont permis de produire en laboratoire des oligosaccharides très complexes liés à des lipides. Jusqu'à présent, cela n'était pas possible avec les synthèses traditionnelles de la chimie organique.
Cela a à son tour offert aux chercheurs de nouvelles perspectives sur la voie métabolique essentielle de la biosynthèse des oligosaccharides liés aux lipides. Les scientifiques peuvent désormais mieux expliquer comment les cellules produisent des glycanes complexes. "Il s'agit d'une étape importante dans la glycobiologie, qui pourrait être significative à l'avenir pour la production de composés sucre-protéine", déclare Locher.
Référence bibliographique
Bloch J et al. Structure et mécanisme de la glucosyltransférase ALG6 basée sur ER. Nature, published online 26th Feb 2020. doi : site externe10.1038/s41586-020-2044-z