L'enzyme qui fait adhérer le sucre aux protéines
Des chercheurs de l'ETH ont réussi à élucider la structure 3D de l'enzyme qui fixe les cha?nes de sucre aux protéines - une percée qu'ils ont récemment publiée dans la revue scientifique "Science".
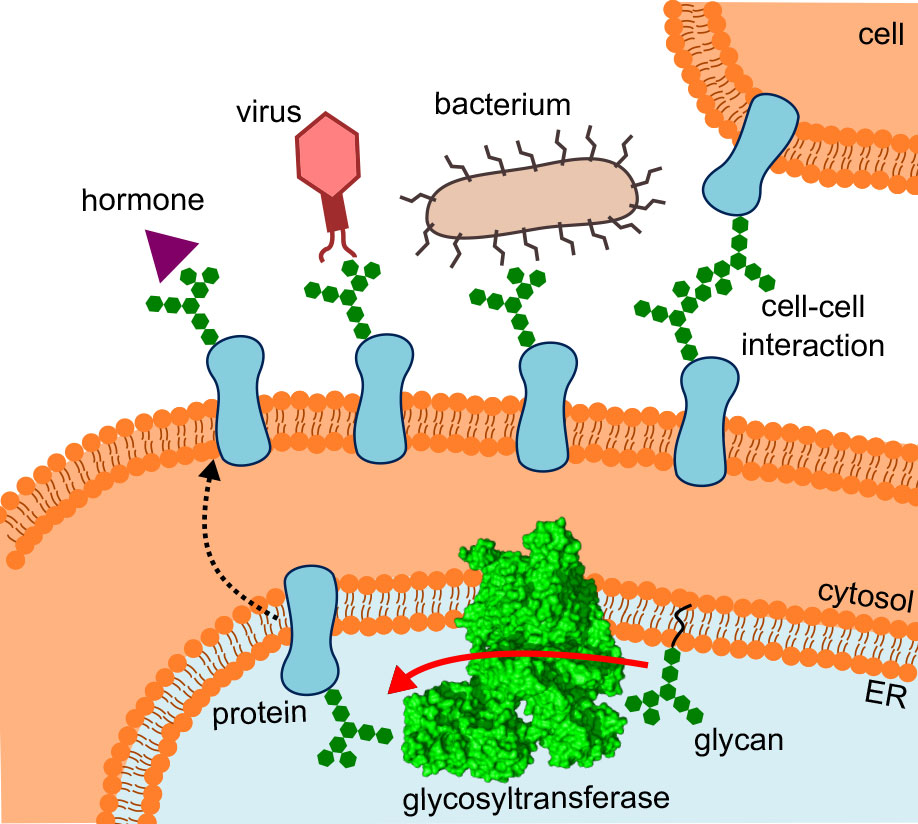
Lorsque les cellules re?oivent des signaux, interagissent avec d'autres cellules ou reconnaissent des virus et des bactéries, ce ne sont pas seulement des protéines qui sont impliquées, mais aussi des cha?nes de sucre qui sont fixées à leur surface. Ces structures de composition et de ramification très différentes, auxquelles on prêtait moins d'attention jusqu'à présent, contribuent apparemment à ce que les protéines puissent se plier correctement et remplir leurs fonctions spécifiques.
Différentes observations montrent l'importance des appendices de sucre : Les mêmes protéines avec des cha?nes de sucre différentes ont des fonctions différentes. Les cellules malades et saines portent d'autres compositions de sucres à leur surface. Et les médicaments qui en sont pourvus sont apparemment mieux tolérés.
Comment le sucre se retrouve-t-il sur les protéines ?
Des recherches intensives sont aujourd'hui menées autour de ces fameux glycanes. Après la génomique et la protéomique, voici la glycomique. Ce domaine de recherche en plein essor qu'est la glycobiologie s'intéresse à la biosynthèse, à la structure et aux multiples fonctions des appendices glucidiques. L'une des questions centrales est de savoir comment les multiples molécules de sucre parviennent à se fixer sur les protéines.
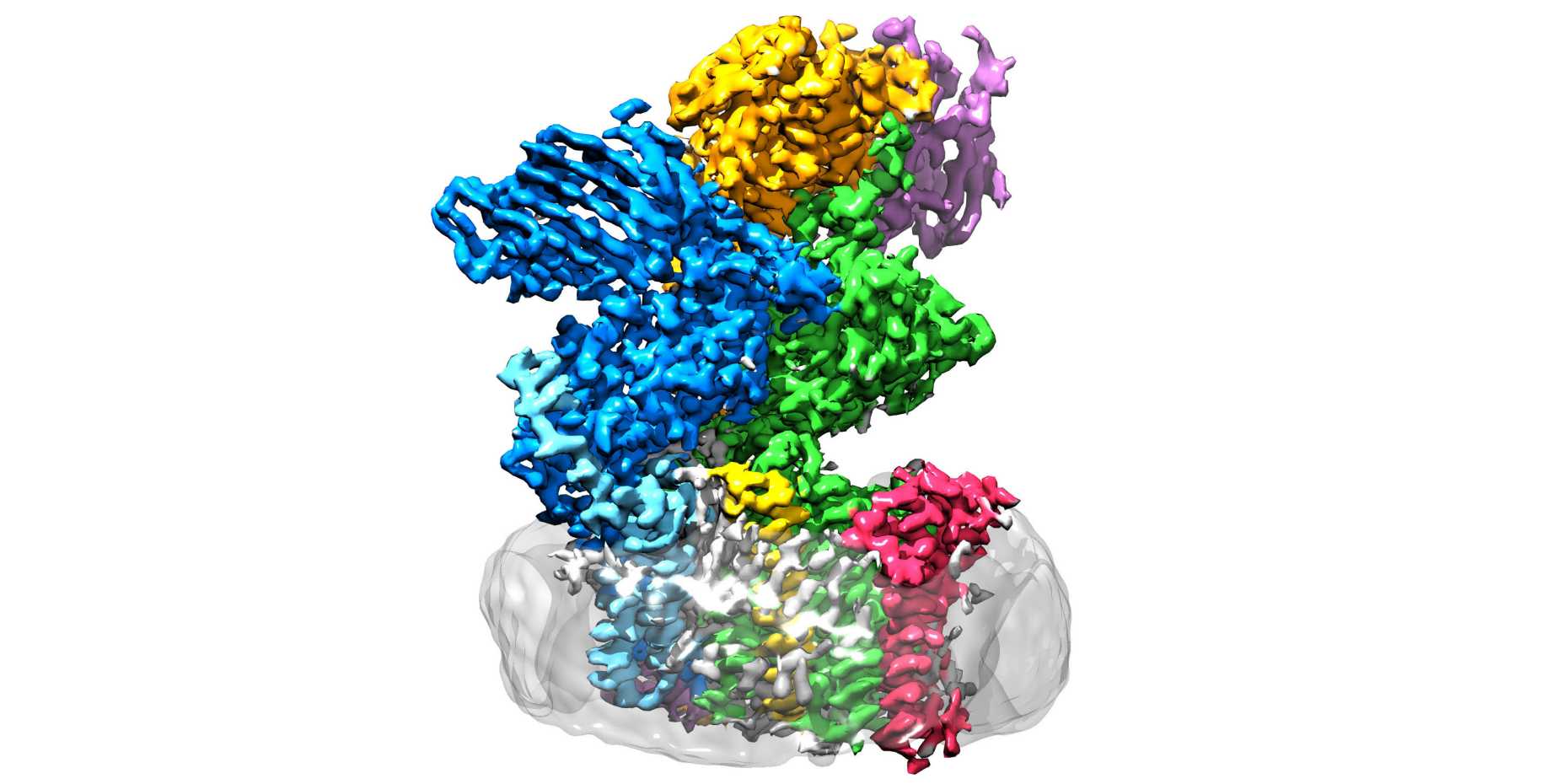
Les chercheurs de l'ETH des groupes de Kaspar Locher, de l'Institut de biologie moléculaire et de biophysique, et de Markus Aebi, de l'Institut de microbiologie, ont maintenant fait avancer la recherche d'un pas décisif sur ce point : ils ont élucidé la structure tridimensionnelle de l'oligosaccharyltransférase (OST) dans la levure. "C'est l'enzyme qui relie les protéines et les 'arbres à sucre'", explique Rebekka Wild, l'une des trois premières auteures de la "site externeScience", dans laquelle les chercheurs de l'ETH présentent leurs découvertes.
La cryo-microscopie électronique rend les choses possibles
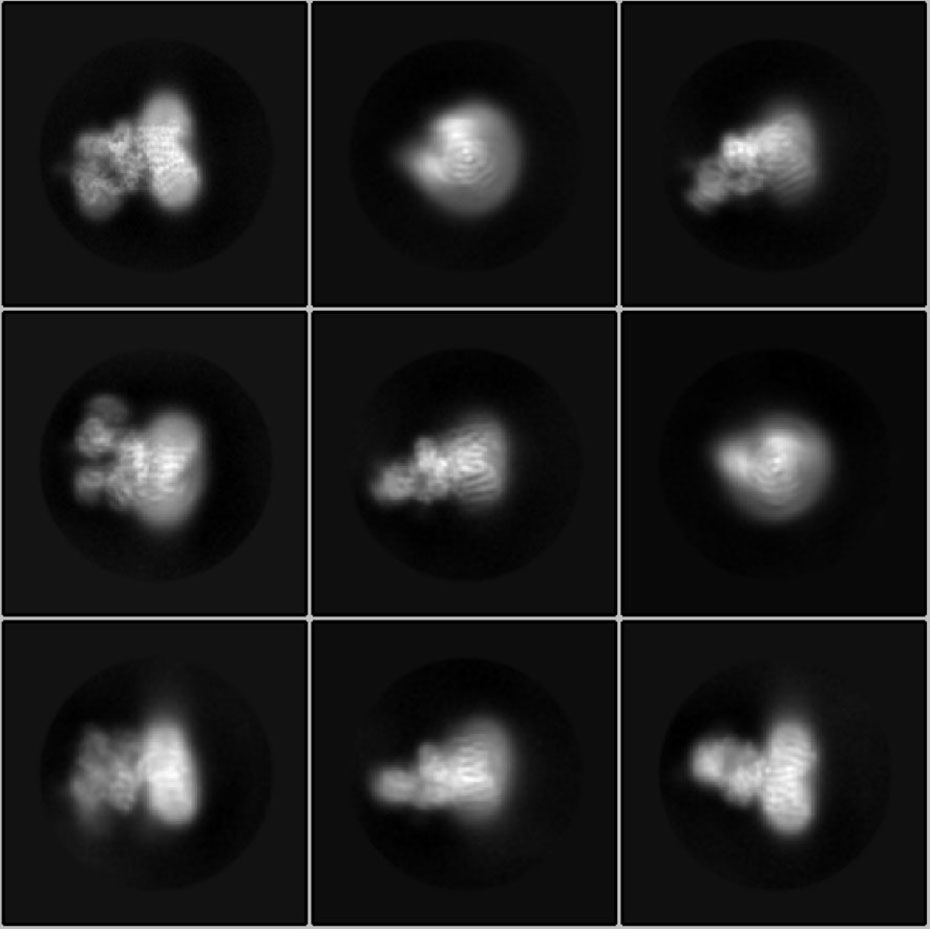
Il n'a pas été facile d'élucider la structure de l'OST : Jilliane Eyring, troisième auteur de la publication, a d'abord modifié les cellules de levure de manière à ce que l'enzyme puisse être purifiée de manière ciblée. Rebekka Wild a ensuite d? extraire l'enzyme, qui est intégrée dans une membrane dans la cellule, de grandes quantités de ces cellules de levure, puis les purifier à grands frais. "Neuf litres de levure ont donné environ 0,2 milligramme d'enzyme", explique-t-elle. Les molécules d'OST ont ensuite été congelées par choc sous forme de particules individuelles et séparées, puis imagées à l'aide d'un cryo-microscope électronique à haute résolution.
Des milliers d'images ont ainsi été prises, montrant le complexe enzymatique sous tous les angles possibles. Sur cette base, Julia Kowal, la deuxième première auteure de la publication Science, a calculé la structure tridimensionnelle de l'OST. Pour cela, l'ordinateur a calculé pendant six semaines. Le résultat : une carte dite de microscopie électronique, sur laquelle l'enzyme est représentée par une sorte de nuage d'électrons.
Un moment propice
"Nous sommes tombés sur un moment heureux", explique Wild. Elle a en effet pu profiter, dans le cadre de son travail, de l'actuelle "révolution de la résolution" en cryo-microscopie électronique et utiliser un appareil ultramoderne d'une résolution presque atomique. Le développement de cette technologie a été récompensé par le prix Nobel de chimie en 2017.
Pour interpréter les données de microscopie électronique, Wild a d? ajuster "à la main" la séquence d'acides aminés de l'OST dans les "petits nuages" de la carte tridimensionnelle. De cette manière, la chercheuse a réussi à représenter la structure 3D de l'OST avec tous les détails - une avancée qui a suscité l'enthousiasme des chercheurs après sa publication en ligne.
Pièce de puzzle correspondante
L'OST est un complexe protéique membranaire composé de huit sous-unités. Celles-ci reconnaissent par exemple le sucre ou la protéine ou stabilisent l'unité catalytique. Cette dernière est la sous-unité de l'enzyme dans laquelle se trouve ce que l'on appelle le centre actif, où les protéines et les sucres sont réunis et fusionnés. "Nous nous attendions à ce que l'unité catalytique se trouve au centre de l'enzyme", explique Wild. "Mais de manière surprenante, elle se trouve à l'extérieur. Et sa forme rappelle celle d'une bouche grande ouverte".
Ce qui a d'abord irrité les chercheurs a soudain pris tout son sens lorsque la chercheuse a ajusté la structure là où l'OST est effectivement utilisée : l'enzyme est en effet intégrée in vivo dans la membrane du réticulum endoplasmique (RE). C'est l'endroit de la cellule où les protéines sont fabriquées, pliées, contr?lées et modifiées.
Le voisin direct de l'OST est - on le savait déjà - une protéine tunnel. Celle-ci fait passer les protéines naissantes à l'intérieur du réticulum endoplasmique - et là, directement dans la bouche ouverte de l'OST. C'est là que les jeunes protéines re?oivent leurs petits arbres en sucre.
Un bon modèle pour l'enzyme humaine
"L'OST de la levure est un bon modèle pour les processus chez l'homme", explique Wild. Les chercheurs en concluent que le centre actif, où les protéines sont équipées de sucres, est très similaire chez l'OST de la levure à la zone correspondante chez les bactéries. "Le centre actif n'a donc pratiquement pas changé au cours de l'évolution", explique la chercheuse, "ce qui signifie qu'il fonctionne très probablement toujours de manière très similaire chez les mammifères, et donc aussi chez les humains".
Référence bibliographique
Wild R, Kowal J, Eyring J, Ngwa EM, Aebi M, Locher KP. Structure of the yeast oligosaccharyltransferase complex gives insight into eukaryotic N-glycosylation. Science 04 Jan 2018 : eaar5140. DOI : site externe10.1126/science.aar5140