Une protéine qui se copie elle-même
Les scientifiques de l'ETH ont pu démontrer dans une expérience qu'une structure protéique très répandue dans la nature - les amylo?des - est en principe capable de se reproduire elle-même. Cela en fait des précurseurs potentiels de molécules considérées comme des éléments constitutifs de la vie.
Ils ont longtemps été considérés comme une aberration de la biologie : les amylo?des. Ce sont des assemblages fibreux de courts morceaux de protéines. Leur mauvaise réputation vient du fait que les amylo?des sont considérés comme la cause de nombreuses maladies neurodégénératives, dont la maladie d'Alzheimer, la maladie de Parkinson ou la maladie de Creutzfeldt-Jakob.
Ce n'est que récemment que les chercheurs ont reconnu que les amylo?des étaient des éléments structurels et fonctionnels présents dans de très nombreuses formes de vie, des bactéries à l'homme en passant par les cellules de levure et autres champignons. Ainsi, chez les vertébrés, ils jouent un r?le dans la production du pigment mélanine, et les cellules de levure forment une sorte de mémoire moléculaire avec des agrégats amylo?des.
Catalyseurs dans l'évolution prébiotique
Comme les fibres amylo?des, composées de courts peptides, peuvent accélérer des réactions chimiques, à l'instar des enzymes, elles sont considérées depuis quelques années comme candidates aux premières molécules précurseurs de la vie. Cependant, il manquait jusqu'à présent la preuve d'une propriété chimique importante pour que les amylo?des puissent jouer ce r?le originel : celle de l'autoreproduction.
Le professeur de l'ETH Roland Riek et son ma?tre-assistant Jason Greenwald du Laboratoire de chimie physique comptent parmi les premiers défenseurs de ce que l'on appelle l'"hypothèse amylo?de". Dans une expérience, ils ont pu montrer que les amylo?des peuvent servir de modèle chimique pour la synthèse de peptides courts. Le point décisif est que "cette capacité s'applique potentiellement aussi aux amylo?des eux-mêmes - les molécules peuvent donc se multiplier elles-mêmes", explique Roland Riek. Les chercheurs rendent compte de leurs résultats dans une étude publiée dans page externeNature Communications.
Gabarit pour l'autocopie
La propriété d'auto-réplication est considérée comme une condition indispensable à toute forme précoce de vie. Avec la preuve de l'autoréplication chez les amylo?des, Riek et son équipe ne montrent pas seulement une autre facette étonnante de ces protéines généralement sous-estimées, mais fournissent également un autre lien qui manquait jusqu'à présent dans la cha?ne d'argumentation de l'hypothèse amylo?de.
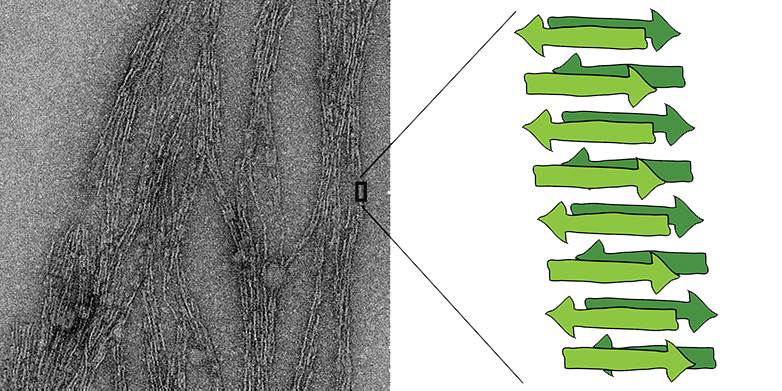
Près de deux ans auparavant, les scientifiques de l'ETH avaient déjà démontré dans une expérience que les structures amylo?des pouvaient se former spontanément avec une étonnante facilité - à partir de simples acides aminés qui existaient probablement déjà sur la Terre inanimée, et dans des conditions de réaction qui semblent également plausibles pour ce que l'on appelle la soupe primitive (Actualités ETH a rapporté).
Il en va de même pour la synthèse peptidique qui vient d'être découverte : "Le mécanisme de réaction semble être de nature générale. Il se déroule de manière stable sur de larges plages de température et de concentration en sel, aussi bien en milieu acide qu'en milieu basique", explique Greenwald.
Cette découverte conforte maintenant les chercheurs dans leur hypothèse selon laquelle les amylo?des pourraient avoir joué un r?le central dans le développement des premières formes de vie, en tant que porteurs d'informations et unités catalytiques, très t?t dans l'histoire de l'évolution.
Probablement pas un "monde à ARN" pur
L'idée la plus répandue à ce jour concernant les débuts moléculaires de la vie est toutefois l'"hypothèse ARN". Elle considère exclusivement les acides ribonucléiques (ARN) comme des acteurs décisifs dans la soupe primitive prébiotique. Ceci parce que les molécules d'ARN peuvent coder des informations de la même manière que la substance héréditaire ADN, mais sont en outre capables d'autoréplication.
Le dogme dominant du "monde de l'ARN" est désormais égratigné par les chercheurs de l'ETH. Selon eux, l'hypothèse de l'amylo?de est en effet plus plausible. D'une part, parce que les molécules d'ARN ayant une fonction biologique sont incomparablement plus grandes et plus complexes, de sorte qu'elles ne peuvent guère se former spontanément dans des conditions prébiotiques. "D'autre part, les amylo?des sont nettement plus stables que les premiers polymères d'acides nucléiques, et ils ont une voie de synthèse abiotique beaucoup plus simple comparée à la complexité des ARN catalytiques connus", explique Greenwald.
Riek ajoute : "Nous ne pourrons bien s?r jamais prouver quel "monde" est le vrai - pour cela, il faudrait revenir sur les 4 à 4,5 milliards d'années d'évolution. Mais nous partons de toute fa?on du principe que ce n'est pas un seul, mais plusieurs "mondes" moléculaires avec différentes molécules précurseurs qui ont participé à l'apparition de la vie".
Référence bibliographique
Rout SK, Friedmann MP, Riek R, Greenwald J : Une synthèse prébiotique de peptides dirigés par des plaques à base d'amylo?des. Nature Communications Volume 9, Article number : 234 (2018) doi : page externe10.1038/s41467-017-02742-3

