Trattamento dell'anemia con le forbici genetiche
La biologa molecolare dell'ETH Mandy Boontanrart è impegnata nella ricerca di terapie geniche che potrebbero correggere i comuni disturbi genetici dell'emoglobina. Ora ha sviluppato un approccio promettente per le cosiddette beta-emoglobinopatie.

Molte malattie ereditarie sono ancora considerate incurabili. L'intervento sul genoma è troppo imprevedibile e complicato, l'esito del cambiamento troppo incerto. Questo perché spesso non un solo gene è coinvolto nella malattia, ma diversi, che possono essere localizzati su cromosomi diversi.
Da quando l'uso delle forbici genetiche CRISPR/Cas9 si è diffuso in modo quasi esplosivo, le regole del gioco sono cambiate in modo massiccio. La modifica mirata di singoli geni o addirittura di blocchi del genoma ha fatto un enorme balzo in avanti negli ultimi anni. Grazie allo sforzo congiunto dei ricercatori di tutto il mondo, la cura delle malattie ereditarie nell'uomo è ora a portata di mano.
Usare le forbici geniche contro le beta-emoglobinopatie
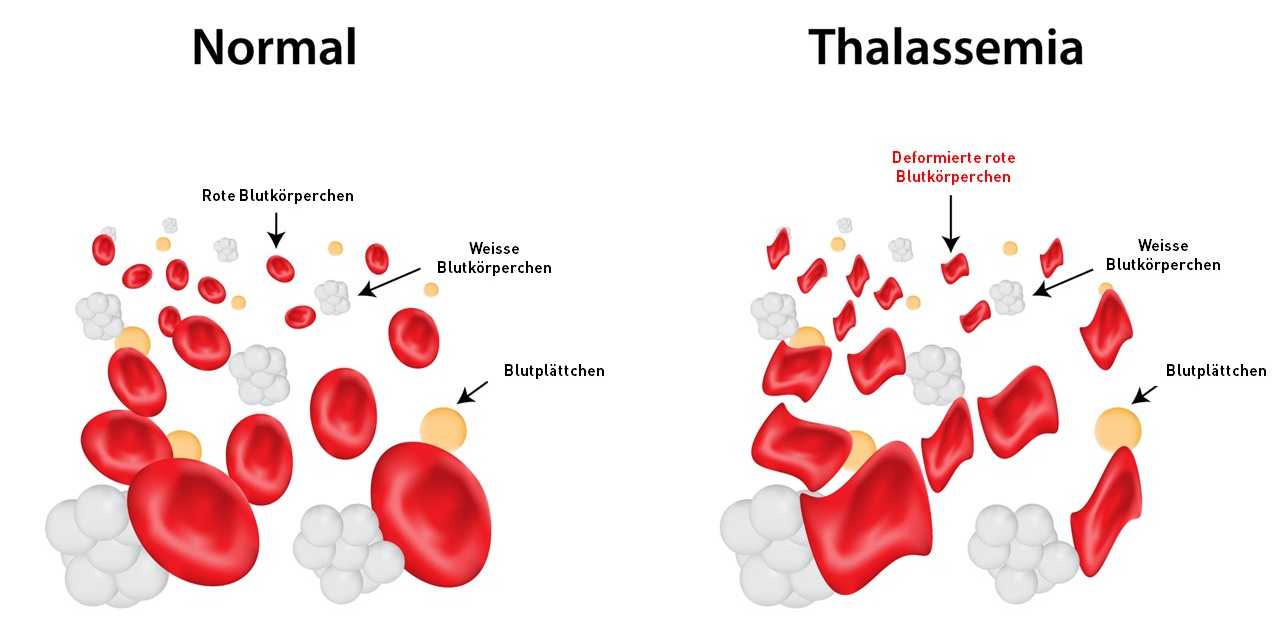
Anche la biologa molecolare Mandy Boontanrart del gruppo del professor Jacob Corn dell'ETH vuole affrontare una malattia ereditaria utilizzando la tecnologia CRISPR/Cas9. Ha appena collaborato a uno studio che potrebbe rivelarsi innovativo per il trattamento delle beta-emoglobinopatie ereditarie, due forme di anemia. Queste includono la beta-talassemia e l'anemia falciforme, due delle malattie ereditarie più comuni al mondo.
Le beta-emoglobinopatie sono causate da mutazioni nel gene HBB. Si tratta del progetto di una catena proteica chiamata beta-globina, un componente del pigmento rosso del sangue emoglobina, che si trova in milioni di globuli rossi ed è responsabile del trasporto di ossigeno nel corpo. Di norma, negli adulti l'emoglobina è composta da due alfa-globine e due beta-globine. Esiste anche una piccola quantità di emoglobina composta da due alfa-globine e due delta-globine. Quest'ultima funziona allo stesso modo della beta-globina, ma viene prodotta naturalmente solo in quantità molto ridotte nei globuli rossi.
Se una mutazione nel gene HBB porta a una produzione errata di beta-globine, si verifica una mancanza di emoglobina funzionante. In genere, questo può portare alla morte prematura dei globuli rossi. Questo porta all'anemia. Gli organi e l'intero corpo sono quindi cronicamente sottoalimentati di ossigeno.
Se solo una copia del gene HBB è mutata, gli sponsor della mutazione possono condurre una vita più o meno normale. "Anche se una persona con una mutazione avrà difficoltà a diventare un atleta professionista, potrà comunque fare jogging, nuotare e andare in bicicletta", dice Boontanrart, che è lei stessa portatrice di un gene mutato. Se entrambe le copie del gene sono difettose, la situazione diventa problematica: "Se si vogliono avere figli con un partner che ha anche lui la mutazione, i bambini potrebbero ricevere entrambi i geni mutati, uno dal padre e uno dalla madre. Questi bambini sarebbero gravemente malati".
Aumentare la produzione di delta-globina
Tuttavia, non è disponibile un trattamento efficace per le beta-emoglobinopatie. Nel nuovo studio, Boontanrart e i suoi colleghi dimostrano che il problema potrebbe essere risolto promuovendo la formazione di delta-globina, che sostituisce la beta-globina difettosa. "Gli esseri umani producono naturalmente solo piccole quantità di delta-globine. Ciò è dovuto a una speciale sequenza di controllo del DNA che impedisce la trascrizione del gene corrispondente". I ricercatori hanno quindi pensato di modificare questa sequenza di controllo in modo da aumentare la produzione di delta globina.
Per ottenere questo risultato, Boontanrart ha utilizzato le forbici genetiche CRISPR/Cas9. L'ha usata per inserire tre segmenti di DNA aggiuntivi nelle cellule progenitrici del sangue a monte del gene HBD, il progetto della delta globina. Questi stimolano il macchinario cellulare a produrre più delta-globina, cosa che ha avuto successo.
I risultati sono promettenti: "Siamo stati in grado di aumentare significativamente il contenuto di delta-globina a un livello che potrebbe essere terapeuticamente efficace", afferma il ricercatore.
Tuttavia, l'inserimento di diversi elementi di DNA è ancora una sfida importante. "? più impegnativo della tecnica utilizzata da altri gruppi di ricerca e dalle aziende farmaceutiche", sottolinea Boontanrart. I ricercatori statunitensi stanno utilizzando il sistema CRISPR/Cas9 anche per affrontare le beta-emoglobinopatie, inducendo le cellule staminali del sangue a produrre emoglobina fetale. Questa è la forma predominante di emoglobina nei feti. La produzione cessa al più tardi alcuni mesi dopo la nascita. L'Hb fetale sostituirà la beta-globina nella nuova terapia. Questo approccio è attualmente all'esame della Federal Drug Administration (FDA) per l'ammissione.

"Aumentare la produzione di delta-globina è, a mio avviso, l'opzione terapeutica migliore".Mandy Boontanrart
Sebbene sia in fase avanzata, questa procedura presenta delle insidie, afferma Boontanrart. Ad esempio, non può essere utilizzata su donne in gravidanza o che desiderano rimanere incinte perché l'emoglobina fetale lega l'ossigeno in modo più forte rispetto all'emoglobina adulta. Di conseguenza, la madre potrebbe sottrarre l'ossigeno al nascituro.
"A mio parere, l'aumento della produzione di delta-globina è l'opzione terapeutica migliore. L'emoglobina delta ha proprietà molto simili alla beta-globina e può essere utilizzata per quasi tutti i pazienti", afferma Boontanrart.
Apertura in fase di costruzione
Per tradurre in pratica i risultati della sua ricerca, Boontanrart ha avviato il progetto Ariya Bio nel 2021 durante la sua borsa di studio per pionieri dell'ETH. Il progetto ha sede presso l'ETH's ieLab di Schlieren, alle porte della città di Zurigo. Nel 2022, l'ETH di Zurigo ha anche presentato una domanda di brevetto per proteggere lo sviluppo.
Boontanrart sta ora preparando studi preclinici con due sovvenzioni successive, una borsa di studio ponte del FNS e un finanziamento di Innosuisse, il programma di promozione dell'innovazione della Confederazione Svizzera. L'inizio di questi studi è previsto per settembre. Con questi studi, i ricercatori vogliono testare per la prima volta l'approccio terapeutico sugli animali per scoprire se è sicuro ed efficace negli organismi viventi. Le prove precedenti sono state effettuate in coltura cellulare.
Il ricercatore spera che tutti gli studi clinici siano completati entro il 2030 e che sia disponibile un prodotto. "Sono ottimista sul fatto che riceveremo l'ammissione più velocemente delle procedure di editing genico attualmente in fase di revisione, perché stanno contribuendo a spianare la strada al nostro approccio".
Riferimento alla letteratura
Boontanrart MY, M?chler E, Ponta S, Nelis JC, Preiano VG, Corn JE (2023) Engineering of the endogenous HBD promoter increases HbA2 eLife 12:e85258. doi: pagina esterna10.7554/eLife.85258