Cristalliser les grandes protéines membranaires
Les chercheurs de l'ETH ont développé une nouvelle méthode pour cristalliser de grandes protéines membranaires en vue d'une élucidation structurelle. La recherche biologique et l'industrie pharmaceutique en profiteront.
Les protéines intégrées dans les membranes sont essentielles pour les cellules et toutes les formes de vie. Non seulement il en existe un très grand nombre, mais elles ont aussi un large éventail de fonctions : celles-ci vont de la communication entre les cellules à la médiation d'une réponse immunitaire, en passant par le transport de substances dans la cellule ou hors de celle-ci. Les protéines membranaires sont considérées comme des cibles thérapeutiques et diagnostiques importantes. Si l'on conna?t leur structure et leurs fonctions, la recherche pharmaceutique peut développer des substances actives qui influencent leurs fonctions de manière ciblée.
Jusqu'à présent, il était toutefois très difficile de clarifier la structure des protéines membranaires. En effet, les chercheurs doivent d'abord isoler ces molécules en grand nombre et former des cristaux à partir d'elles, et c'est précisément là que réside la difficulté : les protéines membranaires ne sont pas solubles dans l'eau et sont souvent trop grandes et hétérogènes pour être cristallisées avec les méthodes courantes.
Cette restriction est désormais levée par le groupe de Raffaele Mezzenga, professeur d'alimentation et de matériaux mous à l'ETH Zurich. Dans une publication parue dans la revue Nature Communications, le groupe présente une méthode générale permettant de cristalliser des protéines membranaires de tout type et de toute taille.
Un mélange de lipides et d'eau comme chambre de réaction
Les chercheurs ont posé les bases de cette méthode dans les années 1990 avec un procédé connu sous le nom de "cristallisation in méso" : Les protéines sont isolées et enrichies à l'aide de mélanges stables d'eau et de lipides, appelés mésophases lipidiques. Dans ces mésophases, un réseau tridimensionnel de tubes d'eau courbés, dont les parois sont constituées de lipides comme dans une biomembrane, se forme de manière auto-organisée. Ces tubes ont un diamètre de trois à quatre nanomètres. Le motif de base cubique du réseau se répète à intervalles réguliers.
Dans de tels tubes, les protéines membranaires s'encastrent dans la paroi avec la partie hydrophobe qui se trouve sinon dans la membrane cellulaire. Le reste de la protéine vient se placer à l'intérieur du tube rempli d'eau. Lorsque les protéines se sont correctement alignées, elles commencent à se cristalliser. C'est justement parce que les tubes offrent si peu de place que seules les petites protéines membranaires ont pu être cristallisées jusqu'à présent. Les plus grandes étaient expulsées et ne formaient pas de cristaux.
Des tubes élargis gr?ce à des lipides chargés
Les chercheurs de l'ETH ont alors utilisé une astuce pour élargir les tubes : ils ont ajouté aux lipides une petite proportion de lipides chargés électriquement. Ceux-ci se repoussent mutuellement et gonflent ainsi les tubes. Leur diamètre a ainsi été porté à 20 nanomètres. Les premiers essais par lesquels les chercheurs tentent d'élargir électrostatiquement les canaux d'eau dans les mésophases lipidiques remontent à l'année 2000. Mezzenga et son équipe sont toutefois les premiers à mettre en évidence une méthode d'application générale.
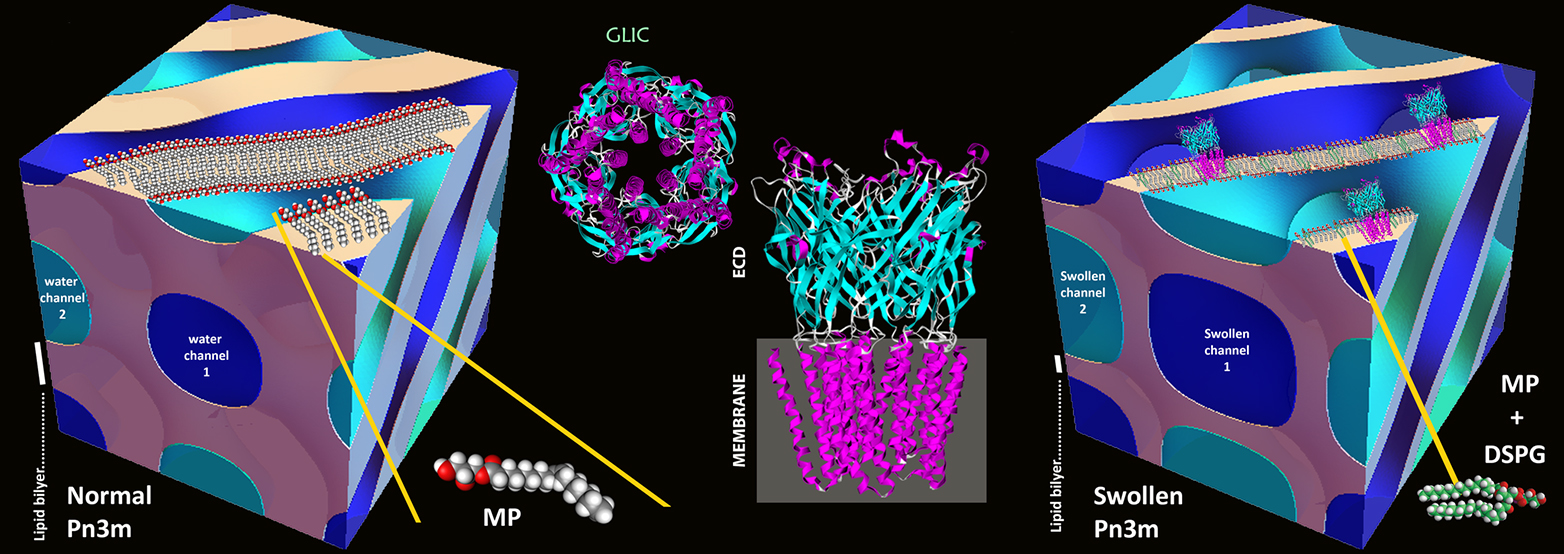
Gr?ce à ces mésophases lipidiques gonflées, les chercheurs de l'ETH ont effectivement réussi à cristalliser de grandes protéines membranaires et à élucider par la suite leur structure. L'un des objets d'exercice des chercheurs de l'ETH était la protéine membranaire GLIC (Gloeobacter ligand-gated ion channel) issue de bactéries.
GLIC possède plusieurs grandes sous-unités qui se trouvent à l'extérieur de la membrane bactérienne, dans l'espace extérieur de la cellule. Jusqu'à présent, la cristallisation de ce complexe s'effectuait par une autre méthode, car ses sous-unités étaient trop grandes. "Notre approche n'a pas seulement amélioré la cristallisation, mais les cristaux étaient aussi extrêmement compacts et appartiennent à un nouveau groupe cristallographique de cette protéine", souligne Mezzenga. En outre, les chercheurs ont pu cristalliser pour la première fois cette protéine de canal dans sa configuration fermée. Jusqu'à présent, d'autres chercheurs n'avaient pu cristalliser ce complexe moléculaire que dans son état ouvert, en utilisant une méthode alternative.
Un coup de pouce attendu pour l'élucidation des structures
La nouvelle méthode générale "in meso" devrait susciter un grand intérêt, surtout chez les biologistes structuraux qui se sont jusqu'à présent cassé les dents sur l'élucidation des grandes protéines membranaires. "Cet outil va donner un nouvel élan à l'élucidation structurelle, car il permet d'accéder à des protéines qui étaient jusqu'à présent hors de portée", déclare Mezzenga.
On ne conna?t aujourd'hui la structure exacte que de 360 petites protéines membranaires, ce qui correspond à environ un septième de toutes les protéines membranaires. Pour le grand reste des protéines membranaires, la structure est inconnue.
Selon Mezzenga, l'industrie pharmaceutique devrait également en profiter. "L'élucidation de la structure est d'une importance capitale pour le développement de nouveaux médicaments", dit-il. "Notre méthode va grandement simplifier cette t?che et lui donner un coup de pouce".
L'aboutissement d'un long projet
Il n'existe pas de brevet pour ce développement. "Nous avons délibérément publié ce travail dans une revue en accès libre afin que tous les chercheurs intéressés puissent y avoir accès sans restriction", souligne Mezzenga, qui a investi plus de trois ans dans ce projet. Il a lancé les premières expériences dès 2015 et y a travaillé en 2016 pendant son congé sabbatique à l'université RMIT de Melbourne. Il a mené d'autres expériences, comme l'élucidation de la structure du GLIC, à la source de lumière synchrotron de l'Institut Paul Scherrer (PSI). Le projet a été financé entre autres par une bourse d'études du Fonds national suisse.
Référence bibliographique
Zabara A, Tse Yin Chong J, Martiel I, Stark L, Cromer BA, Speziale C, Drummond CD, Mezzenga R. Design of ultra-swollen lipidic mesophases for the crystallization of membrane proteins with large extracellular domains. Nature Communications, volume 9, numéro d'article : 544 (2018). doi :page externe10.1038/s41467-018-02996-5