Nano-Sensor misst Faserspannung
Mit Hilfe von Simulationen gelang es einem Forscherteam unter Leitung von ETH-Professorin Viola Vogel ein fadenf?rmiges Peptid zu entwickeln, das den Spannungszustand von Gewebefasern erkennen kann. Das ebnet nun den Weg für komplett neue Forschungsans?tze in der Medizin und Pharmakologie.
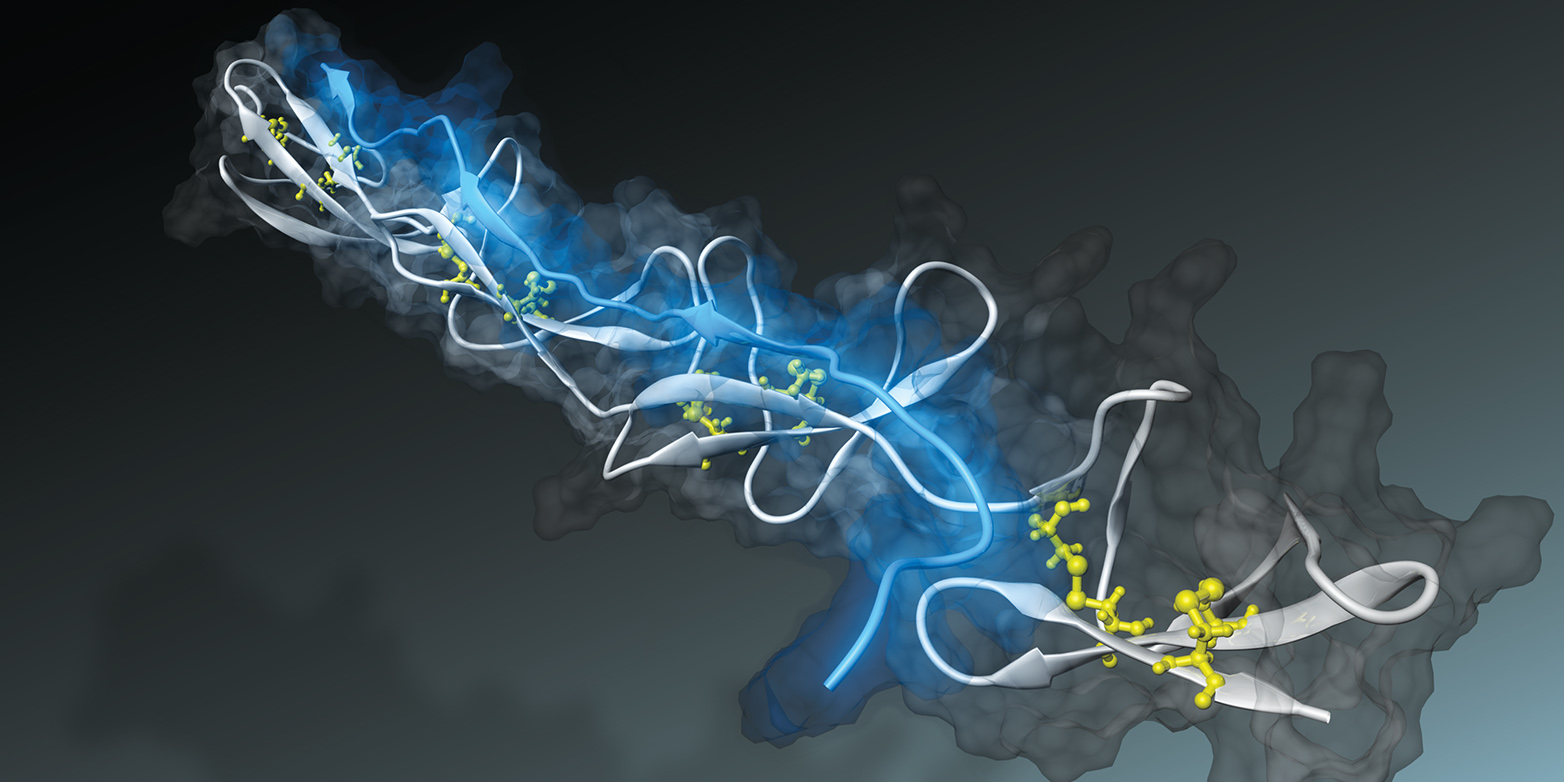
Bakterien k?nnen mit Hilfe eines ?Nano-Klebers? an Gewebefasern anheften. Wie sie das tun, erforschte Viola Vogel, Professorin für Angewandte Mechanobiologie, vor wenigen Jahren mit Hilfe von Computersimulationen am CSCS (externe SeiteETH Lifecall_made berichtete). Die Forscher simulierten, wie der bakterielle Nano-Kleber – ein Peptidfaden, bestückt mit mehreren aneinandergereihten Bindungsstellen – an sogenannte Fibronektinfasern anhaftet. Diese Bindegewebefasern sind in Wunden durchtrennt. Sie sind Teil des fibr?sen Netzwerks, in welche die Zellen eingebettet sind.
Bakterium erkennt Spannung
Zellen ziehen fortlaufend an intakten Fibronektinfasern. Die Simulationen dieses Vorgangs zeigten, dass sobald Fibronektin durch anliegende Kr?fte gestreckt wird, die Abst?nde zwischen den einzelnen Bindungsstellen auf Fibronektin für das bakterielle Peptid zu gross werden. Der bakterielle Nano-Kleber l?ste sich daraufhin gr?sstenteils ab.
Diese Ergebnisse hatten die Forscher damals nicht erwartet. Sie deuteten aber darauf hin, dass das für ihre Simulation genutzte Bakterium Staphylococcus aureus im Laufe seiner Evolution einen Nanosensor entwickelt haben k?nnte, um den Spannungszustand von Fibronektinfasern zu erkennen. Um ?erfolgreich? eine Wunde infizieren zu k?nnen, dürfte sich das gefürchtete Bakterium an zerschnittenen und darum entspannten Fasern anheften.
Doch über den Spannungszustand von Gewebefasern und dessen Einfluss, beispielsweise auf physiologische Prozesse bei degenerative Ver?nderungen im Gewebe, liegen bis anhin kaum Kenntnisse vor. Zudem fehlen geeignete Methoden, um diese von den Zellen erzeugten winzigen Kr?fte auf Gewebefasern messen zu k?nnen.
Viola Vogel und ihre Forschungsgruppe arbeiten deshalb an dafür geeigneten Nano-Senoren: Inspiriert durch die Simulationen entwickelten sie ein bakterielles Peptid, das die Spannungszust?nde von Fibronektin im Gewebe erkennen kann. Ein solches Peptid k?nnte für Therapie und Diagnostik genutzt werden.
Nano-Sensor in echt erfolgreich getestet
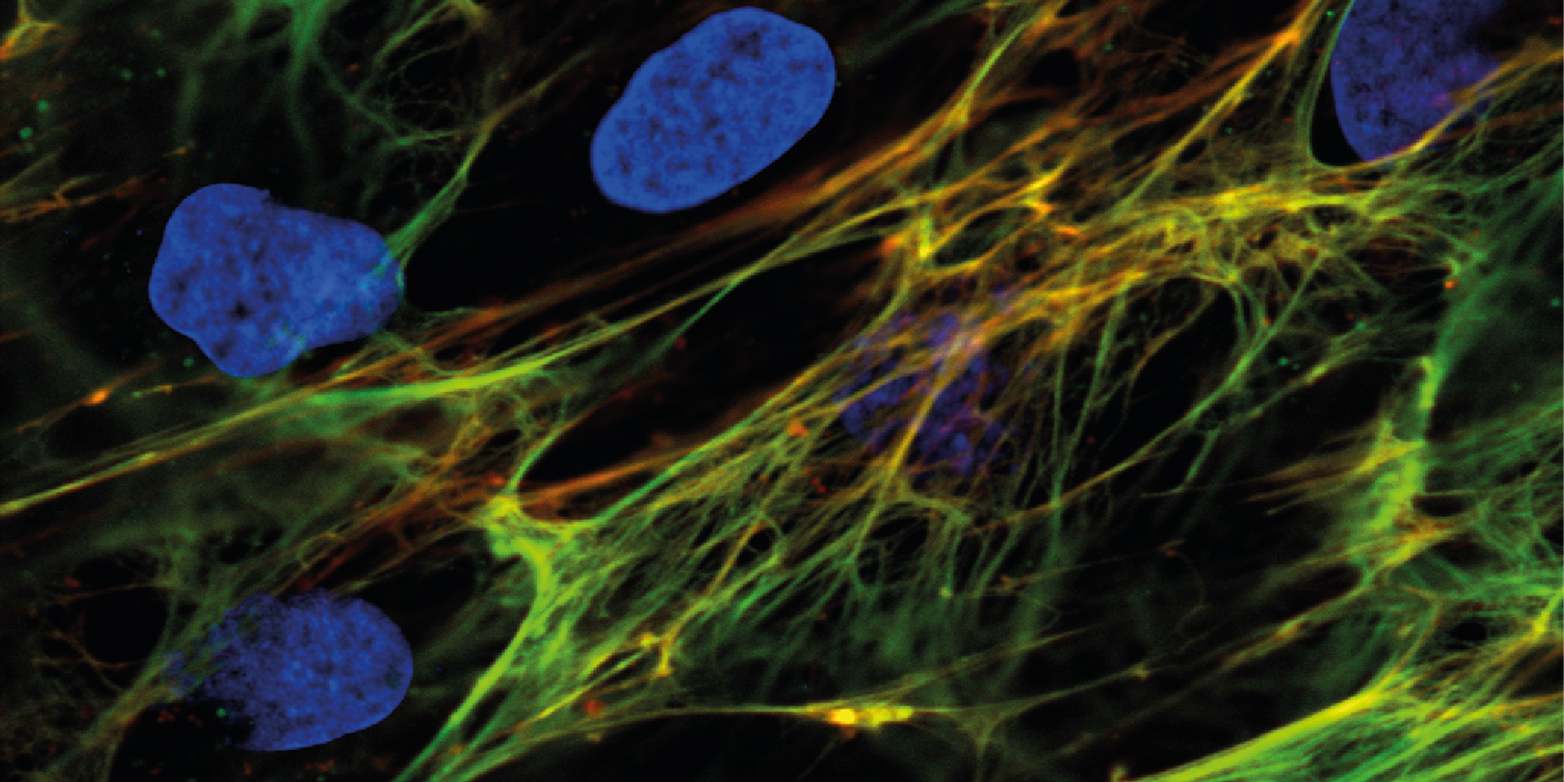
Die Forscher testeten nun das synthetisch hergestellte Peptid sowohl in Zellkulturen wie auch im Tumorgewebe von Tiermodellen erfolgreich. Demnach kann das Peptid die Zugspannung von Gewebefasern in Tumoren sichtbar machen, denn es haftete nur an Fasern an, die nicht unter Spannung standen. Die Ergebnisse wurden heute in der Fachzeitschrift externe SeiteNature Communicationscall_made publiziert.
Um zu testen, ob das Peptid tats?chlich nur an entspannte Fasern anbindet, mischten die Forscher eine von ihnen entwickelte spezielle optische ?Nano-Sonde? in das Zellkulturmedium. Diese Sonde kann nur in Zellkulturen eingesetzt werden und zeigt dort anhand von Farb?nderungen den Spannungszustand der Fasern an. Zugleich markierten die Forschenden das synthetisch hergestellte Peptid mit einem Farbstoff, um erkennen zu k?nnen wo es in Zellkultur bindet.
Darüber hinaus wurden Tumorgewebe mit farbig markiertem Peptid und mit Antik?rpern angef?rbt, die an alle Fibronektine haften. Das machte alle Fibronektinfasern im Tumor sichtbar, w?hrend das Peptid nur an die entspannten Fasern anbindet.
Nicht alle Fasern entspannt
Die detaillierte Untersuchung des Tumors zeigte zum Erstaunen der Wissenschaftler, dass die Peptide nicht an alle Fibronektinfasern anhefteten – ein Anzeichen, dass nicht alle Fasern im Tumor unter Spannung stehen. ?Warum jedoch in manchen Bereichen des Tumors entspanntes Fibronektin geh?ufter vorkommt als in anderen, k?nnen wir noch nicht sagen?, sagt Vogel.
Um herauszufinden, ob sich der bakterielle Klebstoff auch für diagnostische Zwecke eignet, injizierten am Paul Scherrer Instituts (PSI) Forscher unter Leitung von Martin Behé und Roger Schibli im Tiermodell radioaktiv markierte Peptide. Dadurch konnten die Wissenschaftler erkennen, wo im Organismus das Peptid bindet. ?Neben den gut durchbluteten Organen wie Niere, Leber und Milz sammelte sich das Peptid in erster Linie im Tumorgewebe an?, sagt Viola Vogel. Dort verweilte es auch am l?ngsten.
Die Wissenschaftler hoffen, dass sie mit den Peptiden dereinst Tumorgewebe und anderes degeneriertes Gewebe für diagnostische Zwecke markieren k?nnen. Die Peptide k?nnten für die Strahlentherapie oder zur Anlieferung medikament?ser Wirkstoffe an den Krankheitsherd genutzt werden, etwa indem anstelle des Bakteriums ein Wirkstoff an das Peptid anhaftet, der über die Bindungssensoren des Peptids direkt zum Zielort gelangt. Der grosse Vorteil von Peptiden ist, dass sie sehr viel kleiner als Nanopartikel und Antik?rper sind. ?Die fadenf?rmigen Moleküle k?nnen daher viel besser und tiefer in dichtes Tumorgewebe eindringen?, sagt Vogel.
Einsatzm?glichkeiten prüfen
Die Resultate und der neue Forschungsansatz der Forscherin bei der Suche nach neuen Wegen in der Diagnostik und Therapie haben Aufmerksamkeit erregt: Neben einem ERC und einem kürzlich zugeteilten SNF-Grant erhielt Viola Vogel an der renommierten Charité in Berlin eine Einstein-Professur. Damit kann sie zwei Stellen finanzieren, um die neue Technik mit klinischer Forschung zu kombinieren. In Zusammenarbeit mit dem PSI will Vogel zudem prüfen, in welchen Geweben und bei welchen Krankheiten das Peptid einsetzbar ist.
Von den ersten Simulationen am CSCS sowie den Laborversuchen bis hin zum Tiermodell war es ein langer Weg, h?lt Viola Vogel fest. Denn Forschung basierend auf Simulationen werde von den experimentellen Wissenschaften stets kritisch be?ugt. Doch dem h?lt die ETH-Professorin entgegen: ?Wir versuchen über Simulationen unser Denken über molekulare Prozesse zu sch?rfen.? Die Forscherin ist überzeugt, dass die vorliegenden Erkenntnisse ohne Simulationen nicht h?tten erzielt werden k?nnen. ?Damit sind wir eindeutig an dem Punkt angelangt, an dem die Simulation einen Vorhersagewert hat?, sagt Vogel.
Simone Ulmer ist Redaktorin Wissenschaft und Technologie am externe SeiteCSCScall_made, wo dieser Artikel zuerst publiziert wurde.
Literaturhinweis
Arnoldini et al. Novel peptide probes to assess the tensional state of fibronectin fibers in cancer, Nature Communications (2017), DOI: externe Seite10.1038/s41467-017-01846-0call_made.