Bo?te à outils pour la construction de substances actives
Des microbiologistes de l'ETH menés par Markus Künzler ont découvert une enzyme remarquable dans un champignon. Ils souhaitent maintenant l'utiliser pour développer de nouvelles substances actives.
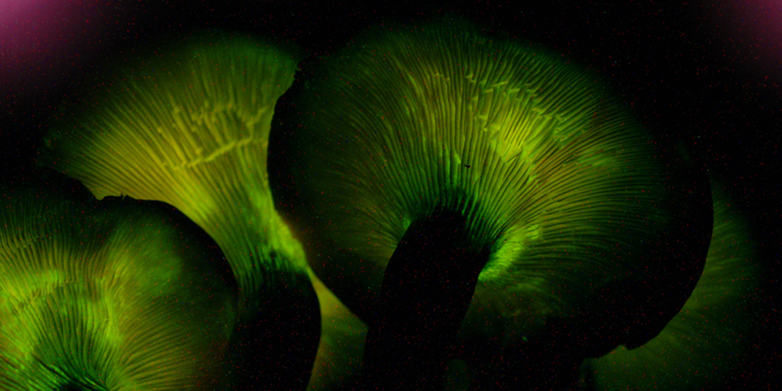
Les champignons semblent être un réservoir quasiment inépuisable de nouvelles substances actives. L'amanite sombre de l'olivier en est un exemple. (Omphalotus olearius), un champignon fréquent dans le bassin méditerranéen, dont le corps fructifère devient fluorescent la nuit.
Ce n'est toutefois pas cet effet spécial qui le rend intéressant pour la recherche médicale, mais une enzyme présente dans ce champignon, que des chercheurs de l'ETH dirigés par le microbiologiste Markus Künzler ont récemment découverte.
Cette enzyme, appelée OphA, est un élément central d'une voie métabolique de défense contre les parasites de l'oleille sombre. "Les champignons se défendent contre les prédateurs ou les concurrents avec un cocktail de différents poisons - dont beaucoup sont des protéines ou des peptides", explique Künzler.
L'oleille sombre utilise l'enzyme OphA pour ajouter des groupes méthyle supplémentaires à l'épine dorsale d'un tel peptide. Ce n'est que le peptide ainsi chimiquement modifié et ultérieurement fermé en un anneau, appelé omphalotine A, qui agit comme poison. Le champignon repousse ainsi les parasites tels que les nématodes.
Cha?ne de production difficilement modifiable
Les peptides issus de champignons servent également de substances actives en médecine. L'un des plus connus est la ciclosporine A. Ce peptide est utilisé depuis bient?t 40 ans pour les transplantations d'organes, les maladies auto-immunes et en cancérologie.
Ce peptide est en forme d'anneau et sponsorise sur son épine dorsale le même type de groupes méthyles que l'omphalotine A. La forme circulaire et les groupes méthyle sont ici déterminants pour les propriétés pharmacologiques avantageuses, notamment la disponibilité orale de la ciclosporine A. Cette dernière propriété reste un obstacle majeur pour les médicaments à base de peptides.
Contrairement à l'omphalotine A, dont l'épine dorsale, comme celle de la plupart des protéines et peptides d'une cellule, est fabriquée par le ribosome, la cyclosporine A est assemblée à partir des acides aminés correspondants par une énorme enzyme spécialement con?ue à cet effet. Cette enzyme fonctionne un peu comme une cha?ne de production dans l'industrie automobile. "Toutefois, cette cha?ne de fabrication ne peut guère être modifiée par la biotechnologie pour produire des variantes de la ciclosporine A avec elle", explique Künzler.
OphA ne fait pas la fine bouche
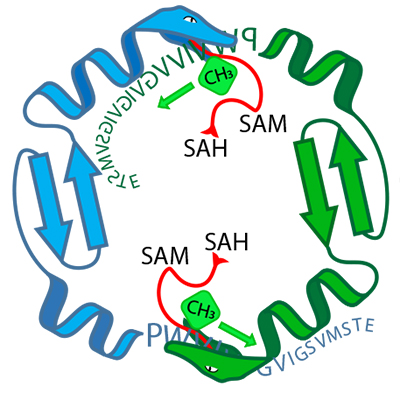
Gr?ce à l'enzyme OphA, il pourrait être possible de produire non seulement des variantes de l'omphalotine A, mais aussi d'autres peptides circulaires d'un type nouveau qui, gr?ce aux groupes méthyle introduits, possèdent des propriétés pharmacologiques aussi favorables que la ciclosporine A.
La base de ce constat est le fait que les peptides traités par OphA sont produits par des ribosomes et peuvent être facilement modifiés via une modification des gènes correspondants. De plus, l'OphA ne semble pas être sélective dans le choix des peptides qu'elle peut modifier chimiquement. L'enzyme est manifestement capable d'ajouter des groupes méthyle à une large gamme de peptides différents.
"En produisant différents peptides de départ par biotechnologie et en les faisant modifier par OphA, nous pouvons théoriquement produire des peptides entièrement nouveaux aux propriétés pharmacologiques intéressantes", explique Künzler.
L'OphA permettrait ainsi de créer des bibliothèques de peptides cycliques contenant des groupes méthyle, qui pourraient être considérés comme des substances actives. De telles bibliothèques de peptides pourraient ensuite être recherchées dans une étape ultérieure pour trouver des peptides présentant une propriété biologique souhaitée, par exemple la liaison à une protéine cible dans le traitement du cancer.
Technologie en cours d'inscription pour un brevet
Les peptides ainsi identifiés constituent des peptides directeurs prometteurs pour le développement de produits thérapeutiques peptidiques correspondants, car il est très probable qu'ils présentent déjà des propriétés pharmacologiques favorables en raison de la présence de groupes méthyle. "Cette approche présente des avantages évidents en termes de rentabilité et de probabilité de succès par rapport aux approches dans lesquelles les groupes méthyle sont introduits chimiquement dans les peptides après coup", explique le microbiologiste.
L'ETH Zurich a déposé une demande de brevet pour l'utilisation de l'enzyme permettant d'introduire des groupes méthyle dans les peptides et pour le procédé de création des bibliothèques de peptides correspondantes. Afin d'apporter la preuve que la technologie fonctionne, Künzler a obtenu une subvention CTI, pour l'instant sans partenaire industriel. La création d'un spin-off est également à l'ordre du jour. "Mais nous devons d'abord apporter la 'preuve de principe' avant de pouvoir obtenir des financements pour un éventuel spin-off". Les deux prochaines années seront sans doute décisives à cet égard.
Des spécialistes enthousiastes
Künzler a re?u de vifs encouragements pour ses développements, du moins de la part des spécialistes. Lors d'une conférence sur les peptides à laquelle il a récemment assisté au Canada, l'intérêt pour son système aurait été grand. Il y aurait même déjà une personne intéressée par l'acquisition d'une licence. "C'est un plaisir d'accompagner la recherche fondamentale vers l'application", dit-il.
Künzler estime que le potentiel des champignons en tant que substances naturelles est en principe très élevé. Il existe plusieurs millions d'espèces de champignons différentes dans le monde et le nombre de substances naturelles prometteuses est par conséquent très élevé. Mais il est aussi réaliste et sait que seule une fraction d'entre elles entrera en ligne de compte pour des médicaments - peut-être que certaines de sa collection de peptides y parviendront.
Référence bibliographique
van der Velden NS, K?lin N, Helf MJ, Piel J, Freeman MF, Künzler M. Autocatalytic backbone N-methylation in a family of ribosomal peptide natural products. Nature Chemical Biology (2017). doi : page externe10.1038/nchembio.2393