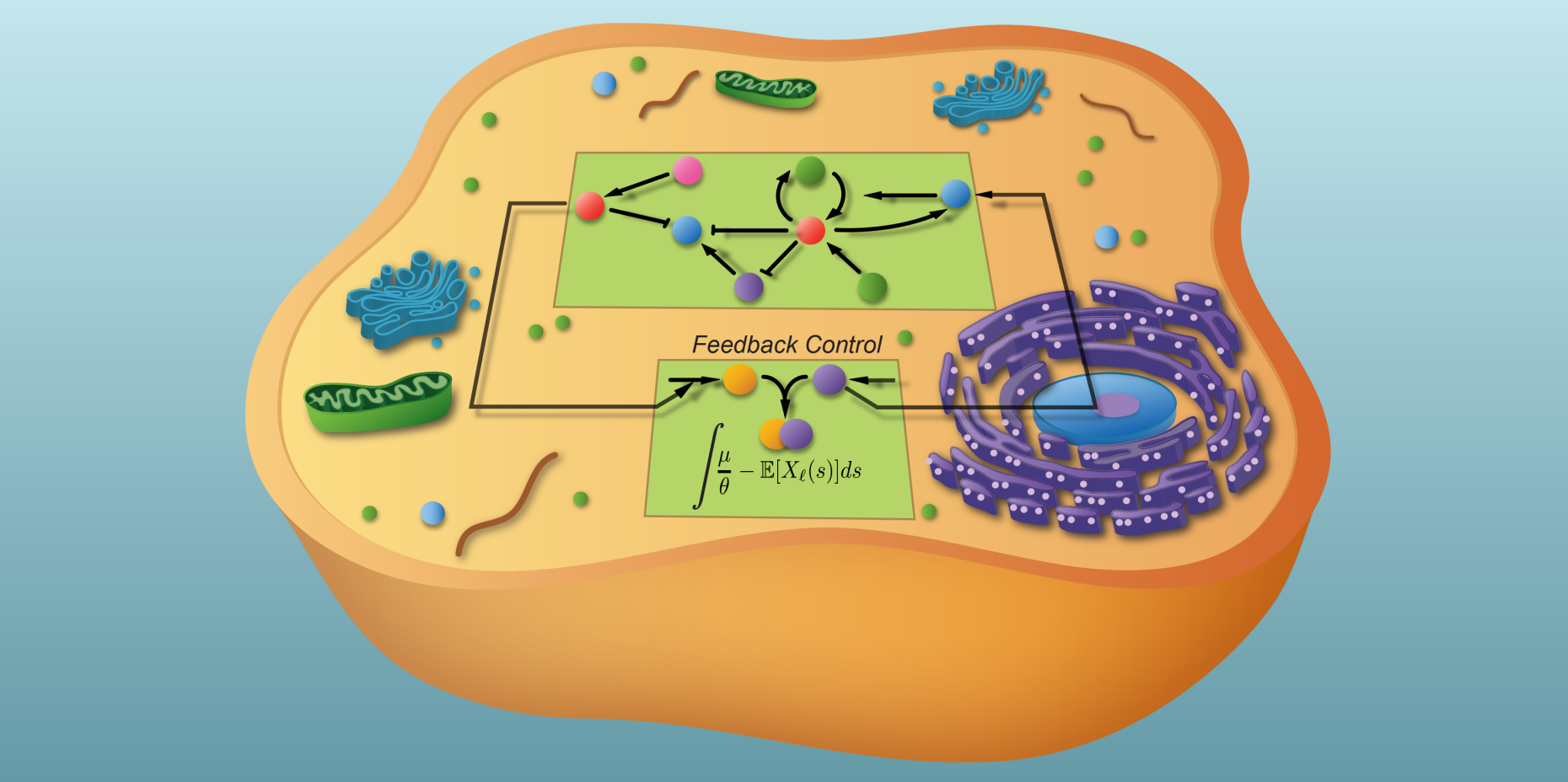
Controllore integrato per le cellule
I ricercatori del Fare all'ETH stanno utilizzando una strategia ingegneristica collaudata per sviluppare un circuito di controllo integrato per le cellule viventi. Questo potrebbe aiutare le cellule a produrre quantità controllate con precisione di un prodotto.
Molte delle applicazioni tecniche odierne non possono più farne a meno: il controllo a retroazione integrale. Tali sistemi di controllo mantengono gli aerei a una certa altitudine, un veicolo a velocità costante in autostrada o un forno industriale alla stessa temperatura. Un sistema di controllo di questo tipo raggiunge generalmente un "adattamento perfetto e robusto" ai disturbi.
Un adattamento perfetto e robusto significa che il sistema di controllo si stabilizza sempre al valore target prestabilito, indipendentemente dai disturbi esterni o dai parametri del sistema da regolare. Un anello di controllo ottiene questo risultato integrando la reazione del sistema da regolare nel tempo. Il segnale risultante viene quindi utilizzato per correggere il sistema da regolare.
Li ha inventati la biologia
Circuiti di controllo di questo tipo si trovano anche in biologia. Regolano la temperatura corporea di un animale a sangue caldo o il bilancio del calcio nei mammiferi. A livello cellulare, sono responsabili del mantenimento dell'equilibrio cellulare, noto come omeostasi.
Tuttavia, non è ancora stato sviluppato un ciclo di controllo biologico sintetico in grado di integrare il feedback del sistema nel tempo. La sfida principale è che nelle cellule viventi è sempre presente un forte rumore di fondo. Questo rumore proviene da molecole che interagiscono in modo casuale e che sono presenti solo in quantità molto piccole. Queste molecole possono anche diventare improvvisamente più frequenti, ma possono anche scomparire completamente in un periodo di tempo più lungo: il caso gioca un ruolo importante in questo caso.
Anello di controllo artificiale in una cellula
Mustafa Khammash, professore di teoria del controllo e biologia dei sistemi presso il Dipartimento di biosistemi di Basilea, e i suoi collaboratori Corentin Briat e Ankit Gupta presentano ora un nuovo approccio al problema. In uno degli ultimi numeri di "Cell Reports", presentano come questo circuito di controllo integrato possa funzionare in una cellula in modo da produrre quantità specifiche e precisamente regolate di una molecola nonostante il forte rumore. I ricercatori chiamano la loro regolazione "controllo integrato antitetico a feedback" (AIFC).
L'AIFC è costituito da due reti: una rete che deve essere regolata e un'altra rete che funziona come unità di controllo e regola la prima. Il collegamento delle due reti consente di ottenere il perfetto adattamento desiderato.
"Abbiamo progettato il circuito di controllo in modo tale da soddisfare tre punti importanti della tecnologia di misurazione e controllo nei sistemi caratterizzati da casualità: Deve essere stabile, il valore target deve essere regolabile e deve consentire un adattamento perfetto e robusto", spiega Khammash. Questo sistema deve funzionare perfettamente anche in un mare impetuoso".
Il rumore stabilizza il sistema
I ricercatori hanno sviluppato una nuova teoria del controllo e un modello informatico per l'ingegneria del controllo a livello molecolare. Ciò smentisce la falsa ipotesi che il rumore sia sempre dannoso per un sistema di controllo. Al contrario, con il loro nuovo sistema dimostrano addirittura che il rumore di fondo nella cellula è un vantaggio per ottenere l'adattamento perfetto e robusto desiderato. "Senza il rumore molecolare, la risposta del sistema inizia a fluttuare", spiega l'ETH. Se si aggiunge nuovamente il rumore, la risposta del sistema si adatta perfettamente al valore target desiderato.
Per corroborare il loro approccio teorico, i ricercatori hanno cercato un AIFC naturale e hanno trovato quello che cercavano. Nel batterio Escherichia coli La catena di segnalazione e di produzione delle proteine è effettivamente strutturata secondo le teorie degli scienziati.
Controllo dei geni grazie all'integrazione della regolazione
In questo circuito di controllo integrato, il valore target è la quantità media di un complesso molecolare costituito da un cosiddetto fattore sigma (s70) e da una RNA polimerasi (RNAP). Il complesso avvia la trascrizione, cioè la lettura dei geni per produrre RNA, le istruzioni per la costruzione di una proteina. Il batterio ha bisogno delle proteine di questa catena di segnalazione per crescere.
Per garantire che la produzione di proteine non vada fuori controllo, viene anche costruita una proteina come "sottoprodotto" che lega strettamente il fattore s70 come anti-s70 e lo rimuove dalla circolazione. Di conseguenza, si formano meno complessi RNAP-s70. Ciò riduce il tasso di trascrizione e anche il livello di anti-s70 nella cellula diminuisce, in modo che le molecole di s70 appena prodotte possano combinarsi di nuovo per formare complessi RNAP-s70. La produzione di proteine aumenta nuovamente.
Con i loro calcoli, i ricercatori dimostrano che questo sistema, che contiene il loro motivo AIFC, si muove verso un valore stabile del complesso. La concentrazione media del complesso sarà giusta per generare la corretta concentrazione di anti-s70.
Paradosso risolto
Secondo i calcoli degli scienziati, la forma libera di s70 è presente solo in quantità minime. Come può agire come regolatore se non è quasi mai presente? "? qui che entra in gioco il rumore nella cellula", spiega Khammash. La frequenza di una proteina regolatrice come s70 fluttua in modo casuale. Tuttavia, una misura statistica della sua casualità, come la frequenza media nel tempo, agisce come un cosiddetto segnale regolatorio deterministico. "Per realizzare un circuito di controllo integrato utilizzando molecole estremamente rare, è essenziale tenere conto della disponibilità media di queste molecole, che cambia nel tempo", sottolinea l'ETH.
Con il loro studio, Khammash e i suoi collaboratori hanno risolto un paradosso. In biologia, ci sono numerosi esempi meravigliosi di omeostasi e adattamento robusti. Ciò suggerisce l'esistenza di anelli di controllo integrati. Tuttavia, non si capisce come la biologia abbia implementato questi anelli di controllo, scrive il professore John Doyle in un commento alla pubblicazione dei ricercatori Fare all'ETH. Questo rompicapo è ancora più sconcertante se si considera che il piccolo numero di molecole presenti è garanzia di un forte rumore, ma che l'adattamento avviene comunque. Il lavoro dei ricercatori di Basilea risolve il paradosso. Perché se i batteri vogliono controllare il loro comportamento Chi siamo, il rumore è un grande vantaggio.
Con questo studio, Khammash e i suoi collaboratori hanno gettato le basi per ottimizzare le future reti regolatorie sintetiche che funzionano come anelli di controllo integrati. Tali reti potrebbero, ad esempio, essere progettate per la produzione stabile e robusta di quantità desiderate di principi attivi medici, di alcuni ormoni come l'insulina o di carburanti prodotti biologicamente.
Riferimento alla letteratura
Briat C, Gupta A, Khammash M: Antithetic Integral Feedback Ensures Robust Perfect Adaptation in Noisy Biomolecular Networks. Cell Systems 2016, 2: 15-26, doi: pagina esterna10.1016/j.cels.2016.01.004
Doyle J. Anche le risposte rumorose possono essere perfette se integrate correttamente. Cell Systems 2016, 2: 73-75, doi: pagina esterna10.1016/j.cels.2016.02.012