La chimie au service de l'économie du méthanol
Le prix du pétrole étant instable et ses ressources limitées, les produits pétrochimiques sont de plus en plus fabriqués à partir de méthanol, notamment en Chine. Des chimistes de l'ETH Zurich viennent de décrypter les premières étapes de ce processus de transformation.
C'est le produit chimique de base le plus produit au monde : l'éthène - une petite molécule composée de deux atomes de carbone et de quatre atomes d'hydrogène. C'est un élément de base pour une grande palette de polymères et de plastifiants. Le polyéthylène (PE), matière plastique d'emballage très répandue, n'est que l'un d'entre eux. Alors que l'éthène est aujourd'hui principalement produit par ce que l'on appelle le craquage du pétrole, une autre voie de production prend de l'importance avec les prix toujours très fluctuants et les réserves limitées de pétrole : sa synthèse à partir du méthanol. Cette étape de synthèse est connue sous le nom anglais de "Methanol-to-olefins" (MTO). Des scientifiques de l'ETH Zurich et de l'ENS Lyon ont maintenant expliqué en détail comment cette réaction commence.
Les chimistes ont développé le processus MTO à la fin des années 1970, et aujourd'hui, des installations de production existent dans le monde entier. Il n'y en a toutefois nulle part ailleurs qu'en Chine : cinq grandes installations y sont en service, treize autres en projet. La Chine a en effet un énorme besoin de produits pétrochimiques, mais pas de pétrole. Le pays dispose toutefois de réserves de charbon, et la gazéification du charbon permet de produire facilement du méthanol. En outre, le méthanol peut être produit à partir du gaz naturel. Les investisseurs chinois prévoient donc de produire du méthanol aux Etats-Unis à partir du gaz de schiste, qui y est abondant, pour l'exporter vers la Chine.
D'où proviennent les ions carbénium nécessaires ?
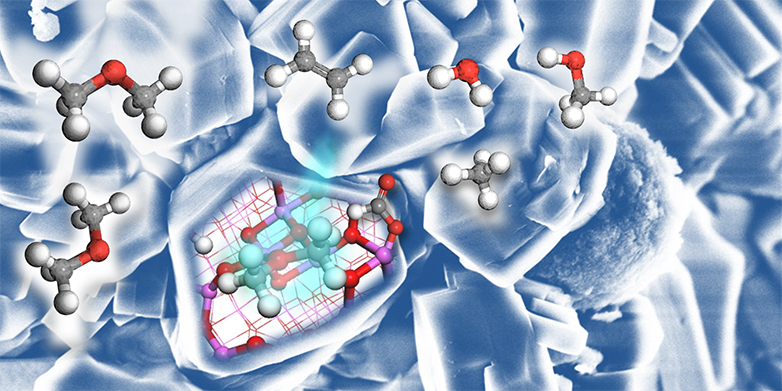
Pour que la réaction MTO ait lieu, des "zéolithes" sont ajoutées au méthanol à 400 degrés Celsius en tant que catalyseur. Ce sont des grains de silicate d'aluminium poreux. Pendant longtemps, les scientifiques n'ont pas pu expliquer précisément le mécanisme chimique de la réaction MTO. Et il y a 20 ans, des chimistes ont postulé qu'une autre molécule devait être impliquée : des molécules d'hydrocarbures en forme d'anneau, chargées positivement, dans lesquelles cinq à six atomes de carbone sont liés entre eux. Ce sont ces molécules, appelées ions carbénium, qui réagissent en fait avec le méthanol : Elles assemblent deux molécules de méthanol et créent une liaison chimique entre deux atomes de carbone, ce qui produit de l'éthène.
Seulement : comment ces ions de carbénium arrivent-ils dans le mélange réactionnel ? Les scientifiques ont très t?t émis l'hypothèse que le méthanol pouvait en être contaminé et que cette impureté était une condition préalable pour que la réaction puisse démarrer.
L'équipe de chercheurs franco-suisse propose maintenant une autre explication. "Nous avons pu montrer que l'oxyde d'aluminium, également présent dans les catalyseurs zéolithiques, peut convertir le méthanol en éthène et autres hydrocarbures. Ces derniers peuvent à leur tour être transformés en ions carbénium dans les pores des zéolithes", explique Christophe Copéret, professeur de chimie des surfaces et des interfaces à l'ETH Zurich et l'un des auteurs de l'étude. "Alors que la réaction MTO fonctionne déjà très bien à l'échelle industrielle, nous expliquons maintenant comment elle se met en place. Notre travail montre en outre que de simples oxydes comme l'oxyde d'aluminium peuvent déclencher la liaison de deux atomes de carbone. Ainsi, de nouvelles voies sont désormais envisageables pour la conversion des dérivés du méthanol en hydrocarbures à plus longue cha?ne".
Référence bibliographique
Comas-Vives A, Valla M, Copéret C, Sautet P : Cooperativity between Al Sites Promotes Hydrogen Transfer and Carbon-Carbon Bond Formation upon Dimethyl Ether Activation on Alumina. ACS Central Science, 5 ao?t 2015, doi : site externe10.1021/acscentsci.5b00226