Spannungsprüfer für schlagende Herzzellen
Wissenschaftlern gelang es erstmals, den Strom durch Membrankan?le in schlagenden Herzmuskelzellen zu messen. Dazu kombinierten sie ein Rasterkraftmikroskop mit einem breit eingesetzten Verfahren zur Messung von elektrischen Signalen in K?rperzellen.
Elektrische Impulse spielen in K?rperzellen eine wichtige Rolle. So leiten etwa Nervenzellen mit solchen Impulsen Informationen entlang ihrer Ausl?ufer weiter, oder der K?rper steuert damit die Kontraktion von Muskeln. Die Impulse entstehen, wenn sich spezialisierte Kanalproteine in der Aussenhülle der Zellen ?ffnen und dadurch geladene Moleküle (Ionen) in die Zelle hinein oder aus der Zelle hinaus gelangen k?nnen. Diese Proteine werden Ionenkan?le genannt. Seit den 1970er Jahren steht Wissenschaftlern eine Methode zur Verfügung, um deren Aktivit?t zu messen. Bisher wurde diese Technik vor allem an Zellen angewendet, die sich nicht bewegen. Elektrotechniker der ETH Zürich und Biologen der Uni Bern haben die Methode nun so weiterentwickelt, dass sie damit auf einfache Weise auch sich bewegende Zellen messen k?nnen, wie zum Beispiel schlagende Herzmuskelzellen in der Zellkulturschale.
In der seit rund vierzig Jahren existierenden Methode führen Wissenschaftler eine Glas-Pipette an die Aussenmembran einer Zelle. Die ?ffnung an der Spitze der Pipette ist so klein, dass sie nur einen Bruchteil der Zelloberfl?che berührt. Idealerweise befindet sich auf diesem kleinen Fleck der Zellmembran genau ein Ionenkanal. Das Innere der Pipette ist mit einer leitenden Flüssigkeit gefüllt, ausserdem befindet sich darin eine Elektrode. So ist es m?glich, Unterschiede in der Ladung zwischen Zell?usserem und Zellinnerem zu messen (das heisst eine elektrische Spannung) sowie kurzfristige ?nderungen in dieser Spannung, die auf die Aktivit?t der Ionenkan?le zurückgehen. Die Methode wird Patch-Clamp-Technik genannt, weil mit der Pipette ein Stück (englisch: patch) der Zellmembran festgehalten (englisch: to clamp) wird.
Rasterkraftmikroskop mit Mikro-Injektionsnadel
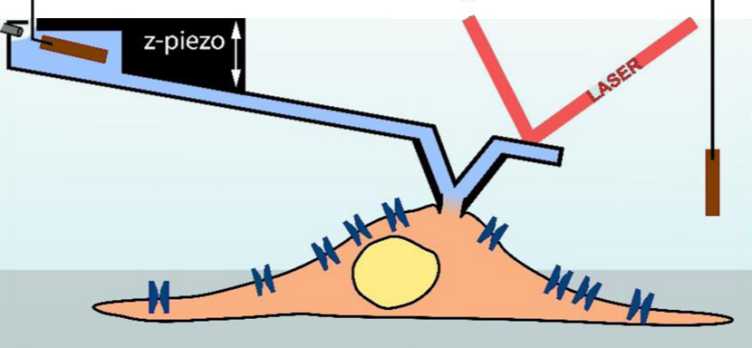
Die Forscher unter der Leitung von Tomaso Zambelli, Privatdozent am Institut für Biomedizinische Technik der ETH Zürich, und Hugues Abriel, Professor am Departement Klinische Forschung der Universit?t Bern, kombinierten nun diese Technik mit einem Rasterkraftmikroskop. Bei diesem sitzt eine Messspitze an einer beweglichen Halterung, einer sogenannten Blattfeder, um die Oberfl?che eines mikroskopischen Objekts abzutasten. Bereits vor einigen Jahren ist es den Forschenden gelungen, Messspitzen mit einem inneren Kanal herzustellen, womit sie computergesteuert Moleküle in eine Zelle injizieren konnten. Diese Technik wird mittlerweile vom ETH-Spin-off Cytosurge vermarktet. Zambelli und seine Kollegen entwickelten diese Technik jedoch noch weiter, indem sie die Mikro-Injektionsnadel mit einer Elektrode bestückten, um damit in Zusammenarbeit mit Wissenschaftlern um Abriel Patch-Clamp-Messungen durchzuführen. Den Erfolg dieses Unterfangens ver?ffentlichten die Forscher nun in der Fachzeitschrift Nano Letters.
Die Patch-Clamp-Technik ist nicht nur eine zentrale Methode in der zellbiologischen Grundlagenforschung, sondern kommt auch routinem?ssig bei der Entwicklung neuer Medikamente zum Einsatz. So muss die Pharmaindustrie im Rahmen des Zulassungsverfahrens von neuen Wirkstoffen von Gesetzes wegen prüfen, ob diese mit Ionenkan?len wechselwirken. Denn ein die Ionenkan?le blockierender Wirkstoff k?nnte bei Patienten zu schweren Herzrhythmusst?rungen führen, was man tunlichst vermeiden m?chte.
L?ngere Messungen und Automatisierung m?glich
Bei der herk?mmlichen Patch-Clamp-Technik führt ein Operateur die Pipette von Hand an die Zelle heran. Es existieren zwar auch automatisierte Verfahren, deren Anwendung ist jedoch limitiert. So müssen die zu untersuchenden Zellen etwa die gleiche Gr?sse und Form aufweisen, und sie dürfen sich nicht bewegen (wie das Herzmuskelzellen tun).
Beim neuentwickelten Verfahren wird die Mikro-Nadel über die Kraft-Messungen des Rasterkraftmikroskops computergesteuert in einem konstant geringen Abstand zur Zelloberfl?che gehalten. ?Dadurch ist der Kontakt zwischen Nadel und Zelle viel stabiler. Wir k?nnen so über eine l?ngere Zeit messen und gar sich bewegende Zellen untersuchen?, erkl?rt Zambelli. Den Forschenden ist es damit erstmals gelungen, in schlagenden Herzmuskelzellen Spannungs?nderungen über Ionenkan?len zu messen. Ausserdem sei es denkbar, auf dieser Grundlage ein automatisiertes Verfahren zu entwickeln, um damit beliebige Zellen unabh?ngig ihrer Form und Gr?sse zu messen, sagt Zambelli.
Literaturhinweis
Ossola D, Amarouch MY, Behr P, V?r?s J, Abriel H, Zambelli T: Force-Controlled Patch Clamp of Beating Cardiac Cells. Nano Letters, 2. Februar 2015, doi: externe Seite10.1021/nl504438zcall_made

