Du verre pour une électrode de batterie
Les batteries lithium-ion actuelles sont bonnes, mais pas assez si notre futur système énergétique repose sur l'électricité. Des chimistes et des chercheurs en matériaux de l'ETH Zurich ont désormais développé un matériau qui, utilisé comme matériau d'électrode dans les batteries lithium-ion, devrait augmenter massivement la capacité et la densité énergétique des batteries actuelles.
Les experts en énergie ne cessent de le répéter depuis un certain temps déjà : à l'avenir, nous aurons besoin de beaucoup plus d'électricité (propre) pour remplacer les énergies fossiles et réduire les émissions de CO2-Le but est de réduire les émissions de CO2. Par exemple, des véhicules électriques devraient circuler sur nos routes à la place des voitures à essence. Mais pour que les véhicules électriques aient une grande autonomie ou que les batteries des téléphones portables durent le plus longtemps possible, il faut des batteries plus nombreuses et de meilleure qualité. Les accumulateurs jouent également un r?le important dans le passage aux sources d'énergie renouvelables, afin de stocker l'électricité excédentaire produite par les installations éoliennes ou solaires et de compenser les fluctuations dans la fourniture d'énergie.
La recherche cherche donc fébrilement de nouveaux matériaux qui, à volume et poids égaux, présentent une densité énergétique plus élevée et une capacité de charge plus importante que les batteries lithium-ion actuelles. Celles-ci fournissent du courant de manière fiable à nos smartphones, voitures électriques et ordinateurs portables, mais elles ne peuvent pas suivre le rythme des exigences croissantes imposées aux batteries. "Ce dont nous avons besoin, c'est de nouveaux matériaux et d'une toute nouvelle chimie pour développer des batteries s?res, meilleures et plus durables", résume Semih Afyon, collaborateur scientifique à l'Institut des matériaux électrochimiques, en évoquant l'idée de base de la recherche sur les batteries.
Des particules de verre plut?t que des cristaux
Des scientifiques de l'ETH, sous la direction de Semih Afyon et du professeur de chimie émérite Reinhard Nesper, ont désormais trouvé ce qu'ils cherchaient. Après plusieurs années de recherche, ils sont tombés sur un matériau qui pourrait doubler la puissance des batteries. Il s'agit d'un verre au vanadate-borate que les chercheurs utilisent comme matériau de cathode, comme ils l'ont récemment rapporté dans la revue spécialisée "Scientific Reports".
Le matériau est composé de précurseurs de pentoxyde de vanadium (V2O5) et le borate de lithium (LiBO2), qui a en outre été recouvert d'oxyde de graphite réduit (RGO), ce qui améliore les performances du matériau en tant qu'électrode.
Les chercheurs ont utilisé un composé à base de vanadium parce qu'il existe de nombreux degrés d'oxydation du vanadium. Le pentoxyde de vanadium, par exemple, peut absorber trois ions de lithium chargés positivement sous forme cristalline, soit trois fois plus que le phosphate de lithium et de fer utilisé dans les cathodes actuelles.
Cependant, le pentoxyde de vanadium cristallin ne peut pas libérer tous les ions de lithium stockés et il ne permet que peu de cycles de charge-décharge stables. En effet, lors de la charge, les ions de lithium pénètrent dans le réseau cristallin, de sorte que les particules d'électrodes gonflent globalement, pour ne rétrécir que lorsque les ions quittent les particules. Cela peut entra?ner une modification de la structure du matériau de l'électrode et la perte de contacts.
Les chercheurs ont donc d? trouver une solution pour que le matériau de l'électrode conserve sa structure tout en maximisant sa capacité. C'est ainsi qu'ils ont eu l'idée d'utiliser un "verre" de vanadium au lieu d'une forme cristalline. Le verre a une structure dite amorphe, dans laquelle les atomes ne s'organisent pas en un réseau régulier comme dans un cristal, mais en un fouillis sauvage.
Une production simple et peu co?teuse
Pour fabriquer le matériau de la cathode de la batterie, les scientifiques ont mélangé du pentoxyde de vanadium en poudre avec des borates formant du verre. "Le verre résultant de ce mélange est un nouveau matériau, en fin de compte ni du pentoxyde de vanadium ni du borate de lithium", explique le chercheur. Le vanadium (V5+) serait néanmoins la substance active qui absorbe les ions lithium lors de la décharge de la batterie.
Les chercheurs ont fait fondre la poudre à 900°C et ont refroidi la masse fondue le plus rapidement possible. Ils ont ainsi obtenu des plaquettes de verre très fines qui, avant d'être utilisées, ont été réduites en poudre afin d'augmenter la surface et de créer un espace poreux. "L'un des grands avantages du verre boraté au vanadate est sa fabrication simple et peu co?teuse", souligne Afyon. Selon lui, cela augmente les chances d'une application industrielle.
Afin de créer une électrode performante, le chercheur a en outre revêtu la poudre de borate de vanadate d'oxyde de graphite réduit (RGO). Celui-ci augmente d'une part la conductivité et protège d'autre part les particules de l'électrode. Il n'entrave toutefois pas le transport des électrons et des ions de lithium à travers l'électrode.
Afyon a finalement con?u la cathode à partir de ce nouveau matériau, qu'il a utilisé dans des prototypes de piles boutons.
Jusqu'à deux fois plus de courant
? des fins de test, le chercheur a soumis ces prototypes à de nombreux cycles de charge-décharge. Lors des premiers essais avec des électrodes de vanadate-borate non revêtues de RGO, la capacité de décharge a chuté drastiquement après 30 cycles de charge-décharge, dès que la quantité de charge stockée a été augmentée à 400 milliampères par gramme (mA/g). En revanche, avec le revêtement RGO, la capacité est restée stable pendant plus de 100 cycles de charge-décharge, même à des taux de courant assez élevés.
Une batterie avec une électrode de vanadate-borate revêtue de RGO avait une densité énergétique d'environ 1000 wattheures par kilogramme. Elle atteignait une capacité de décharge nettement supérieure à 300 mAh/g (milliampère-heure par gramme). Au début, cette capacité était même de 400 mAh/g, mais elle a diminué au fil des cycles de charge et de décharge.
"Cette énergie suffirait néanmoins à alimenter un téléphone portable en électricité pendant une fois et demie à deux fois plus longtemps que les batteries lithium-ion actuelles", estime Afyon. Cela pourrait également multiplier l'autonomie d'une voiture électrique par une fois et demie. Mais ces valeurs sont encore de nature mathématique.
Brevet et développement
Ce nouveau matériau est également intéressant pour l'industrie : l'entreprise Belenos, avec laquelle les chercheurs ont collaboré, a déjà déposé une demande de brevet pour ce développement. Les bons résultats obtenus par les chercheurs avec le verre au vanadate-borate les ont encouragés à poursuivre leurs recherches. Un consortium dirigé par Jennifer Rupp, professeure en matériaux électrochimiques, dans lequel Afyon est chef de projet, travaille sur un nouveau type de batterie à l'état solide. L'électrode de vanadate-borate est déjà utilisée et testée dans ce système. Ils s'efforcent maintenant d'optimiser le système. Le nombre de cycles de charge-décharge, notamment, doit encore être fortement augmenté, ce qui pourrait être obtenu par une meilleure conception de la batterie et de l'électrode ainsi que par des revêtements alternatifs au lieu de l'oxyde de graphite réduit, explique Afyon.
Comment fonctionnent les batteries lithium-ion ?
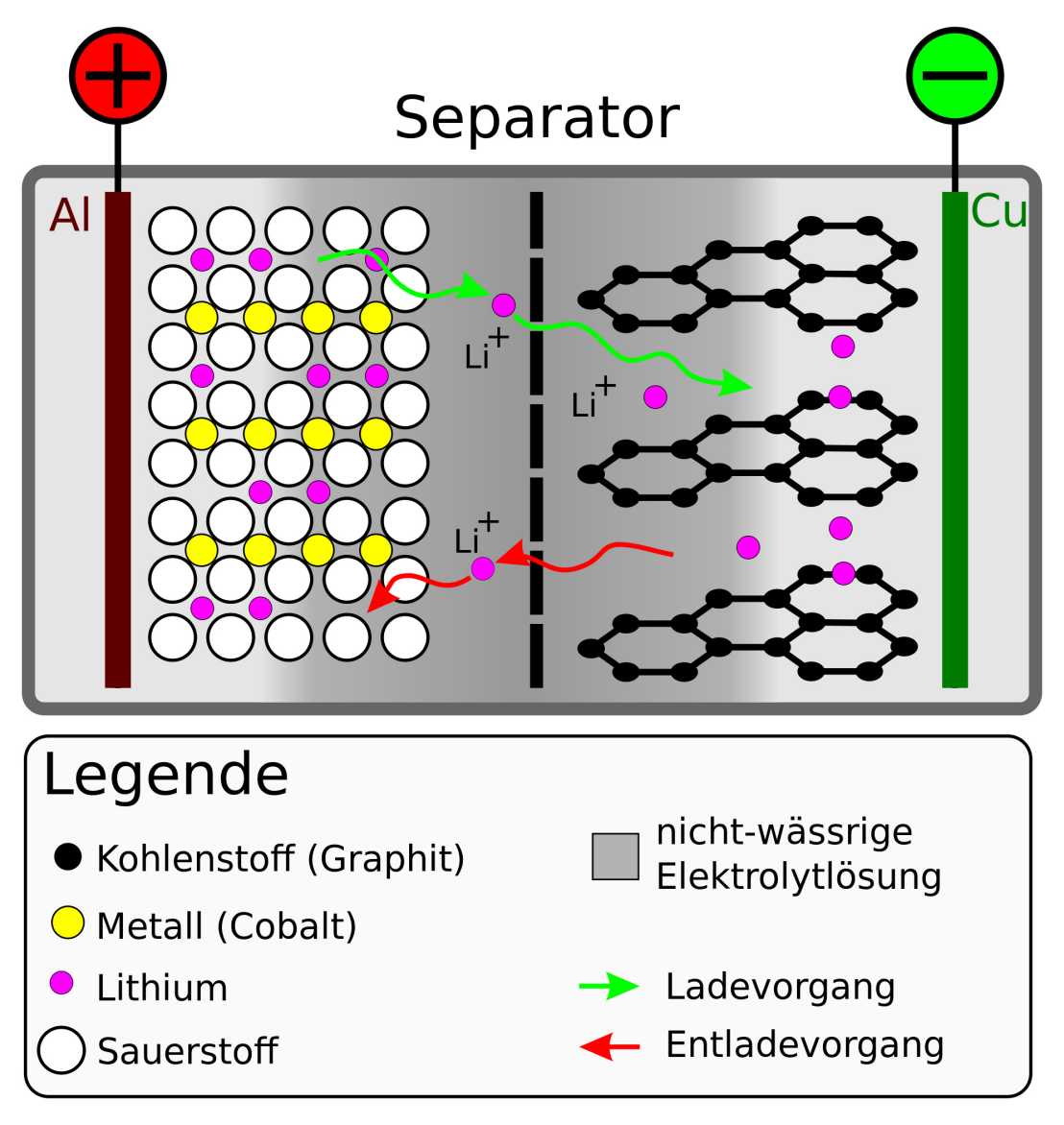
Les batteries lithium-ion actuelles sont composées de deux électrodes - une cathode et une anode. L'anode est souvent composée de graphite, la cathode d'oxydes métalliques comme l'oxyde de cobalt. Les ions de lithium se nichent dans ces matériaux lors de la charge ou de la décharge. Les électrodes sont séparées par une cloison qui ne laisse passer que les ions lithium. Lors de la décharge, les ions de lithium se déplacent de l'anode vers la cathode. Les électrons de ce dernier ne passent pas à travers la paroi de séparation et font donc un détour par un appareil électronique qui est alimenté par le courant d'électrons qui en résulte. Les électrons et les ions se rencontrent à nouveau à la cathode. Lors de la charge, ils sont contraints de circuler dans le sens inverse. Pour qu'une batterie fonctionne bien et longtemps, les ions doivent pouvoir se déplacer facilement dans et hors des matériaux des électrodes. La forme et la taille du matériau de l'électrode ne doivent pas non plus être modifiées de manière significative par l'absorption et la libération répétées des ions.
Référence bibliographique
Afyon S, Krumeich F, Mensing C, Borgschulte A, Nesper R (2014) : Nouveaux matériaux de cathode haute capacité pour les batteries Li-ion rechargeables : verres au vanadate-borate. Scientific Reports 4, numéro d'article : 7113. doi : page externe10.1038/srep07113
