Un nouvel antibiotique issu d'un champignon du fumier de cheval
Des chercheurs de l'Institut de microbiologie de l'ETH Zurich ont découvert dans un champignon qui pousse sur le fumier de cheval une nouvelle protéine qui a un effet antibiotique. Les chercheurs explorent maintenant différentes possibilités d'application.
Des microbiologistes et des biologistes moléculaires de l'ETH Zurich et de l'Université de Bonn ont découvert dans des champignons une nouvelle substance active qui tue les bactéries. La substance appelée copsine a donc le même effet que les antibiotiques classiques, mais elle appartient à une autre classe de substances biochimiques : La copsine est une protéine, alors que les antibiotiques classiques sont des composés organiques, mais pas des protéines.
Les chercheurs, sous la direction de Markus Aebi, professeur de mycologie, ont découvert la substance active dans le tintinnabulement du fumier hirsute. (Coprinopsis cinerea), un champignon qui pousse sur le fumier de cheval et que l'on trouve également dans notre pays. Au début de leur travail de recherche, les scientifiques se sont intéressés à la manière dont ce champignon et différentes bactéries s'influen?aient mutuellement dans leur croissance. Pour ce faire, ils ont cultivé le champignon en laboratoire avec différentes espèces de bactéries. Il s'est avéré que le tintin est capable de tuer certaines espèces. En poursuivant leurs recherches, les scientifiques ont pu démontrer que la copsine produite par le champignon était responsable de cet effet antibiotique.
La copsine fait partie de ce que l'on appelle les défensines. Il s'agit de petites protéines que de nombreux organismes vivants fabriquent pour se défendre contre les micro-organismes pathogènes. Le corps humain produit également des défensines pour se protéger des infections. On a pu les détecter par exemple sur la peau ou dans les muqueuses.
Question de recherche fondamentale
Pour Aebi, ce n'est pas tant l'application de la nouvelle substance active qui était au premier plan de ce travail de recherche. "Nous verrons bien si la copsine sera un jour utilisée comme antibiotique en médecine. Ce n'est pas du tout certain, mais ce n'est pas non plus exclu", dit-il.
Ce qui passionne le professeur de l'ETH, ce sont plut?t les questions fondamentales. Ainsi, depuis des millions d'années, les champignons utilisent avec succès des défensines et d'autres substances antibiotiques naturelles pour se défendre contre les bactéries. Pourquoi cela fonctionne-t-il pour les champignons, alors que l'humanité utilise certes également des antibiotiques en médecine depuis 70 ans, mais que nombre d'entre eux sont déjà inutilisables en raison de résistances ? "Les champignons ont un mode d'emploi interne sur la manière d'utiliser ces substances sans sélectionner de bactéries résistantes. Décrypter ce mode d'emploi est une question passionnante pour la recherche fondamentale", explique Aebi.
Protéine extrêmement stable
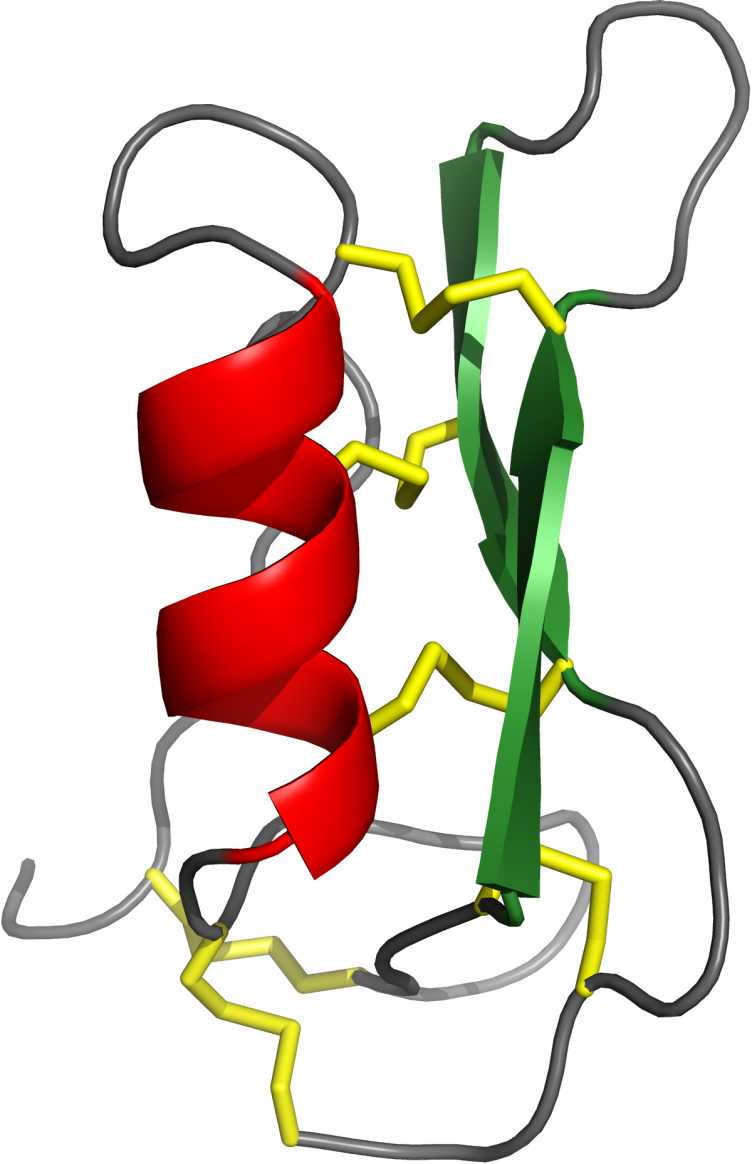
Andreas Essig, postdoctorant dans le groupe d'Aebi et premier auteur de l'étude, explore actuellement les applications possibles de Copsin, pour lequel l'ETH a déposé une demande de brevet. Ce sont les propriétés biochimiques de la substance active qui ont motivé Essig. "La copsine est une protéine extraordinairement stable", explique Essig. En règle générale, les protéines sont sensibles aux enzymes dégradant les protéines et aux températures élevées. La copsine est une exception : elle reste stable même si elle est chauffée à 100 degrés Celsius pendant plusieurs heures ou si elle est exposée à des enzymes dégradant les protéines. Les scientifiques supposent que la protéine possède ces propriétés parce qu'elle a une structure tridimensionnelle très compacte, comme ils l'ont découvert par spectroscopie RMN.
Les chercheurs de l'ETH ont également pu décrypter le mode d'action exact. Ils ont ainsi découvert que la copsine peut se fixer sur le lipide II, un matériau de construction de la paroi cellulaire des bactéries. "L'assemblage de la paroi cellulaire est le talon d'Achille des bactéries", explique Essig. Si la copsine se fixe au lipide II, les bactéries meurent car elles ne peuvent plus former une nouvelle enveloppe cellulaire.
Outre une utilisation comme antibiotique en médecine, une application dans le domaine alimentaire serait également envisageable. En effet, la copsine tue entre autres les listeria. Il s'agit de bactéries qui peuvent provoquer de graves intoxications alimentaires et qui sont donc particulièrement redoutées lors de la production d'aliments d'origine animale non chauffés comme le fromage au lait cru ou la viande séchée.
Référence bibliographique
Essig A, Hofmann D, Münch D, Gayathri S, Künzler M, Kallio PT, Sahl HG, Wider G, Schneider T, Aebi M : Copsin, a novel peptide-based fungal antibiotic interfering with the peptidoglycan synthesis. Journal of Biological Chemistry, publication en ligne du 23 octobre 2014, doi : page externe10.1074/jbc.M114.599878
