Warum Fresszellen in gesundem Gewebe fasten
ETH-Wissenschaftler zeigten, dass die Fresszellen des Immunsystems nicht nur biochemisch, sondern auch mechanisch reguliert werden. Dies k?nnte erkl?ren, warum die Zellen in gesundem K?rpergewebe weniger aktiv sind.
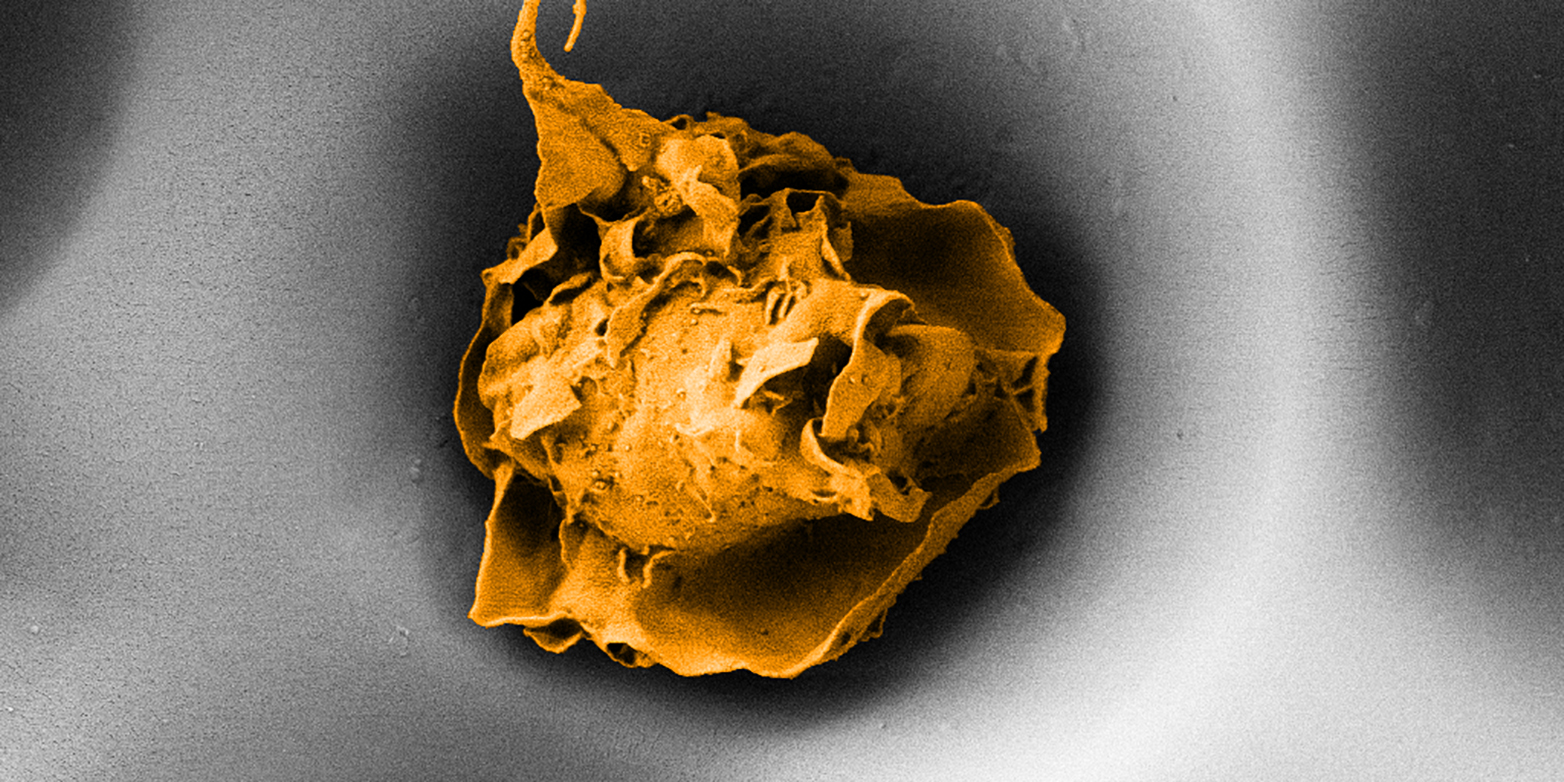
Makrophagen sind ein Typ von weissen Blutzellen. In unserem K?rper stehen sie unter anderem als ?Fresszellen? im Einsatz: Sie spüren bakterielle Krankheitserreger auf, verleiben diese ein und setzen eine Entzündungsreaktion in Gang, welche den Infektionsherd bek?mpft. Reguliert werden die Makrophagen von Botenstoffen und anderen biochemischen Substanzen. Diese Moleküle sorgen dafür, dass die Makrophagen bei Bedarf ihre Aktivit?t hochfahren und nach getaner Arbeit wieder herunter.
Viola Vogel, Professorin am Departement Gesundheitswissenschaften und Technologie, und ihr Postdoktorand Nikhil Jain haben nun einen neuen Weg entdeckt, wie die entzündungsf?rdernden Makrophagen reguliert werden: über r?umliche Information. Wenn Makrophagen im Gewebe zwischen anderen Zellen sitzen und von diesen eingeengt werden ist ihre Aktivit?t ged?mpft, und zwar selbst dann, wenn hochregulierende Botenstoffe vorhanden sind.
Keine unn?tigen Entzündungsreaktionen
?Makrophagen zirkulieren nicht nur im Blut, sondern sitzen auch in allen m?glichen Geweben. Quasi als W?chter warten sie dort, bis sie gebraucht werden?, erkl?rt Vogel. Für den K?rper sei es sehr wichtig, dass sich Makrophagen in intaktem Gewebe ruhig verhalten, andernfalls k?me es zu unn?tigen Entzündungsreaktionen. ?Erst wo Gewebe gesch?digt wird, müssen Makrophagen aktiv werden.? Was die entzündungsf?rdernde Reaktion der Makrophagen in gesundem Gewebe d?mpft, habe man bisher nicht voll verstanden.
Dass diese Fresszellen nicht nur biochemisch, sondern auch mechanisch reguliert werden, schliessen die ETH-Wissenschaftler aus Zellkulturexperimenten im Labor. Sie verwendeten dazu unter anderem spezielle Zellkulturschalen mit poren?hnlichen Vertiefungen, in denen die Zellen einzeln eingesperrt wurden.
Diese Experimente erlaubten es den Forschenden auch, den dahinterliegenden molekularen Mechanismus zu entschlüsseln. Die Funktion eines Makrophagen ist n?mlich an seine Gr?sse gekoppelt: Wird seine Funktion hochreguliert, w?chst er, indem sein Zellskelett erweitert wird. Dies setzt Faktoren frei, welche die Aktivit?t der Gene beeinflussen. Wird der Makrophage hingegen von aussen eingeengt, kann er nicht wachsen.
Krankheiten verstehen und Implantate verbessern
Die neue Erkenntnis, dass r?umliche Faktoren die Aktivierung von Makrophagen steuern, hat Auswirkungen auf das Verst?ndnis verschiedener Krankheiten. ?Es gibt eine Reihe von Leiden, die dadurch verursacht werden, dass der K?rper Makrophagen ungenügend unter Kontrolle h?lt und diese Zellen entzündungsf?rdernde Botenstoffe produzieren?, erkl?rt Vogel. Zu diesen Krankheiten geh?rten Rheuma, Arteriosklerose, Fettleibigkeit, Krebs und einige Autoimmunerkrankungen.
Ausserdem führe die Erkenntnis zu neuen Ideen, wie die Oberfl?chen von Implantaten strukturiert werden k?nnten, um Entzündungen zu reduzieren, sagt Vogel. ?Wir zeigen, dass die Oberfl?chenstruktur eines Materials die Reaktion von Makrophagen beeinflusst.? Nun k?nne man zum Beispiel der Frage nachgehen, ob bei Implantaten mit por?sen Oberfl?chen weniger Narbengewebe darum gebildet wird, worauf es bereits erste Hinweise gebe.
Literaturhinweis
Jain N, Vogel V: Spatial confinement downsized the inflammatory response of macrophages. Nature Materials, 22. Oktober 2018, doi: externe Seite10.1038/s41563-018-0190-6call_made
